
| A.Cu2S在反应中既是氧化剂,又是还原剂 |
| B.Cu既是氧化产物,又是还原产物 |
| C.该反应中氧化剂只有Cu2O |
| D.每生成19.2g Cu,反应中转移0.6mol电子 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:实验题
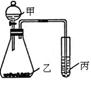
| 实验试剂 | 实验结论 | ||
| 甲 | 乙 | 丙 | |
| ① | 高锰酸钾 | ② | 氧化性:KMnO4>Cl2>Br2 |
 (1)图中①为 ,②为 。
(1)图中①为 ,②为 。 (2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表;
(2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表;| 试剂甲 | 试剂乙 | 试剂丙 | 丙中现象 | 实验结论 |
| | | | | 酸性:盐酸>碳酸 |
| | | 石蕊试液 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.①④ | C.②③④ | D.③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com