
【题目】已知烃D在标准状况下的密度为1.25g·L-1,C、H都是具有浓郁香味、不易溶于水的油状液体。相关物质转化关系如下(转化条件都已省略):
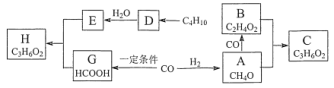
请回答:
(1)B中官能团的名称是____。
(2)C4H10→D的反应条件是____。
(3)E+G→F的化学方程式____。
(4)下列说法正确的是____。
A. C、H属于同一种物质
B. 可以用新制氢氧化铜悬浊液鉴别B、E和G
C. 有机物A、G在一定条件下反应所得产物是B的同分异构体
D. 一定条件下A转化成G,B转化成E,都属于氧化反应
【答案】羧基 高温 CH3CH2OH+HCOOH ![]() HCOOCH2CH3+H2O BC
HCOOCH2CH3+H2O BC
【解析】
D在标准状况下的密度为1.25gL-1,标况下其摩尔质量=1.25g/L×22.4L/mol=28g/mol,则D为CH2=CH2,D和水发生加成反应生成E为CH3CH2OH,E、G发生酯化反应生成H为HCOOCH2CH3,CO和氢气反应生成A,C、H都是具有浓郁香味、不易溶于水的油状液体,为酯,则B为羧酸、A为醇,根据C原子个数知,A为CH3OH,B为CH3COOH,C为CH3COOCH3,结合题目分析解答。
D在标准状况下的密度为1.25gL-1,标况下其摩尔质量=1.25g/L×22.4L/mol=28g/mol,则D为CH2=CH2,D和水发生加成反应生成E为CH3CH2OH,E、G发生酯化反应生成H为HCOOCH2CH3,CO和氢气反应生成A,C、H都是具有浓郁香味、不易溶于水的油状液体,为酯,则B为羧酸、A为醇,根据C原子个数知,A为CH3OH,B为CH3COOH,C为CH3COOCH3;
(1)B为CH3COOH,B中官能团的名称是羧基;
(2)C4H10→D的反应为烷烃的裂解反应,该反应条件是高温;
(3)E是CH3CH2OH,G是HCOOH,E+G→F的化学方程式CH3CH2OH+HCOOH ![]() HCOOCH2CH3+H2O;
HCOOCH2CH3+H2O;
(4)A.C是乙酸甲酯、H是甲酸乙酯,所以C、H不属于同一种物质,是同分异构体,故错误;
B.B为乙酸、E为乙醇、G为甲酸,乙酸和新制氢氧化铜悬浊液发生中和反应得到澄清溶液、E和新制氢氧化铜悬浊液互溶、G和新制氢氧化铜悬浊液在加热条件下发生反应生成砖红色沉淀,现象不同,所以可以用新制氢氧化铜悬浊液鉴别B、E和G,故正确;
C.A为甲醇、G为甲酸,则A、G在一定条件下得到的产物是甲酸甲酯,B是乙酸,二者分子式相同而结构不同,所以有机物A、G在一定条件下反应所得产物是B的同分异构体,故正确;
D.A为甲醇、G为甲酸、B是乙酸、E是乙醇,A转化为G为氧化反应,B转化为E为还原反应,故错误;
故答案为BC。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A.HCO3-在水溶液中的电离方程式:HCO3- +H2O![]() H3O++CO32-
H3O++CO32-
B.H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C.CO32-的水解方程式:CO32- +2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CuSO4的水解方程式: Cu2++2H2O=Cu(OH)2↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,纳米0价金属能去除地下水中的NO3-,不同初始pH和不同金属组成对NO3-的去除效果如图所示。图1初始pH=5.5,图2初始pH=2,NO3-初始浓度均为50mg·L-1,纳米级金属添加量均为2g·L-1。下列说法正确的是
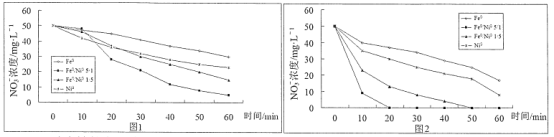
A.纳米铁的去除效果优于纳米镍
B.图2纳米铁反应60mn时NO3-去除率67.2%,则60min内![]()
C.当加入的金属是Fe0/Ni05/1,在不同的初始pH下,经过60min后,NO3-的去除率相等
D.其他条件相同时,若pH过低,可能会导致去除率下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol某烃在氧气中充分燃烧生成CO2和H2O,需要消耗标准状况下的氧气179.2L。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是
A.CH3CH2CH2CH2CH3B.![]()
C.![]() D.
D.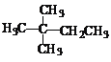
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列叙述中错误的是( )
①标准状况下,2.24L水中含有0.1NA个水分子
②常温常压下,32g SO2 含有的分子数约为3.02×1023
③2molNaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤标况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol
⑥2mol/L的CaCl2溶液中Cl-的数目为4NA
⑦常温常压下,1mol氦气含有的原子数为NA
⑧11.2L氯气中含有NA个氯原子
A.①③④⑥⑧B.①④⑤C.①②⑤D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
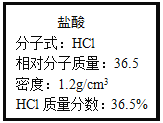
(一)该浓盐酸的物质的量浓度为______mol/L.
(二)某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为0.3mol/L稀盐酸,可供选用的仪器有:①胶头滴管②烧瓶③烧杯④药匙⑤量筒⑥托盘天平⑦玻璃棒 ,请回答下列问题:
(1)配制稀盐酸时,上述仪器中不需要使用的有______(选填序号),还缺少的仪器有______(写仪器名称).
(2)下列对容量瓶及其使用方法的描述中正确的是______.
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后,必须烘干
C.容量瓶可用来长期储存溶液
D.使用前要检查容量瓶是否漏水
(3)该学生需要量取______mL上述浓盐酸来配制。
(4)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)________________________;
A.用30mL水洗涤烧杯2--3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(5)在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏高”或“偏低”或“无影响”).
I、用量筒量取浓盐酸时俯视观察凹液面______
II、用量筒量取浓盐酸后,洗涤量筒2--3次,洗涤液也转移到容量瓶______
III、溶液注入容量瓶前没有恢复到室温就进行定容______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是良好的半导体材料,它的发现和使用引起了计算机的一场“革命”。它可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯)
Si(纯)
下列说法不正确的是( )
A.步骤③中氢气作还原剂
B.硅和二氧化硅都能用作计算机“芯片”
C.步骤①的化学方程式为:SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.步骤①②③中发生的反应都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下的HCl气体4.48 L溶于水形成100 mL溶液,然后与足量的铁屑充分反应。计算:
(1)所得盐酸溶液的物质的量浓度_______________
(2)参加反应的铁的质量____________
(3)生成的H2的体积(标况)___________
(4)将生成的FeCl2配成400 mL溶液,此溶液中FeCl2的物质的量浓度____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成3种链状二肽
缩合最多可形成3种链状二肽
B.用酸性![]() 溶液可鉴别乙炔和乙醛
溶液可鉴别乙炔和乙醛
C.丙烯酸![]() 含有二种官能团,只能发生取代反应和加成反应
含有二种官能团,只能发生取代反应和加成反应
D.等质量的甲醛和乳酸![]() 完全燃烧消耗的氧气相等,生成水的质量也相等
完全燃烧消耗的氧气相等,生成水的质量也相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com