
| A. | ①②⑤ | B. | ②③⑥ | C. | ②⑤⑥ | D. | ①③④ |
分析 ①铁在氧气中生成四氧化三铁;
②二氧化硅是酸性氧化物与碱反应生成盐与水,盐酸的酸性强于硅酸;
③氯化铝是共价化合物;
④钠在氧气中点燃生成过氧化钠;
⑤二氧化硫与水反应生成亚硫酸,亚硫酸与氧气反应生成硫酸;
⑥饱和NaCl与氨气、二氧化碳反应生成碳酸氢钠和氯化铵,碳酸氢钠受热分解生成碳酸钠.
解答 解:①铁在氧气中生成四氧化三铁,而不是氧化铁,故错误;
②二氧化硅是酸性氧化物与碱反应生成盐与水,盐酸的酸性强于硅酸,所以盐酸与硅酸钠反应生成硅酸,能实现各步转化,故正确;
③氯化铝是共价化合物,应是电解离子化合物氧化铝,生成铝和氧气,故错误;
④钠与氧气中点燃生成过氧化钠,而不是氧化钠,故错误;
⑤二氧化硫与水反应生成亚硫酸,亚硫酸与氧气反应生成硫酸,能实现各步转化,故正确;
⑥在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,析出NaHCO3,加热NaHCO3分解生成碳酸钠,故正确;
故选C.
点评 本题考查元素化合性质、侯德榜制碱法等,难度中等,注意侯德榜制碱法要先通氨气,后通二氧化碳,以便获得高浓度离子溶液.


科目:高中化学 来源: 题型:选择题
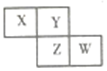 如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )| A. | W的原子序数不可能是X的原子序数的3倍 | |
| B. | Z元素可能为金属 | |
| C. | 四种元素的原子有可能均能与氢原子形成18电子分子 | |
| D. | W的气态氢化物的稳定性一定比Y的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml 0.1mol/L的氯水中通入0.01molSO2气体 | |
| B. | 100ml 0.5mol/L的NaOH中通入0.005mol氯气 | |
| C. | 100ml 0.5mol/L的CuSO4溶液中加入4g NaOH固体 | |
| D. | 100ml自来水中加入0.01mol蔗糖溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示实验装置可用于制取乙炔.请填空:
如图所示实验装置可用于制取乙炔.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
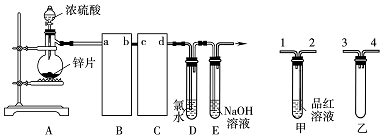
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水蒸气、液态水和冰中,水分子都在不停地运动 | |
| B. | NaCl溶于水后,因为共价键被破坏,从而形成了Na+和Cl- | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | H2S分子中,所有原子的最外层都达到了8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凑近集气瓶中闻氯气的气味 | |
| B. | 圆底烧瓶可以用酒精灯直接加热 | |
| C. | 金属钠着火时,用沙子扑灭 | |
| D. | 浓盐酸沾到皮肤上,用氢氧化钠溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | + | =1 | - | + | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
| A. | 以上10种元素的原子中,失去核外第一个电子所需能量最少的是⑧ | |
| B. | 由⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl5和CCl4 | |
| C. | 某元素R的原子半径为1.02×10-10 m,该元素在周期表中位于第三周期第ⅤA族 | |
| D. | 若物质Na2R3是一种含有非极性共价键的离子化合物,则其化合物的电子式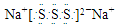 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在放电时,两极质量均增加 | |
| B. | 在充电时,电池中硫酸的浓度不断变小 | |
| C. | 在放电时,负极发生的反应是 Pb+2e-+SO42-=PbSO4 | |
| D. | 在放电时,正极发生的反应是 PbSO4+2e-=Pb+SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com