
| 2��12-1��4 |
| 5 |
| 0.1mol/L��0.02L��1 |
| 1 |
| 0.16g |
| 0.2g |


 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ���⡱������Ҫ�Ļ���ԭ�ϣ�Ҳ��δ�������������Դ��
���⡱������Ҫ�Ļ���ԭ�ϣ�Ҳ��δ�������������Դ��| ���� |
| c(CH3CH2OH)��C3(H2O) |
| C2(CO2)��C6(H2) |
| c(CH3CH2OH)��C3(H2O) |
| C2(CO2)��C6(H2) |
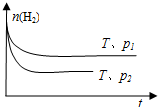
| n(H2) |
| n(CO2) |
| �¶ȣ�K�� | 500 | 600 | 700 | 800 |
| CO2ת���ʣ�%�� | 60 | 43 | 28 | 15 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A.3.63��10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�����͵�﮵�أ��������������˽���﮺�ʯī���缫����������Һ�����Ⱥ�����ﮣ�LiAlCl4���ܽ��ڶ�������������ṹʽ�ǣ�![]() �����γɵģ�ԭ��صĵ缫�ܷ�Ӧʽ�ǣ�8Li��3SOCl2��6LiCl��Li2SO3��2S�����й����������͵�ص�˵���д������
�����γɵģ�ԭ��صĵ缫�ܷ�Ӧʽ�ǣ�8Li��3SOCl2��6LiCl��Li2SO3��2S�����й����������͵�ص�˵���д������
A����ع��������У�SOCl2����ԭΪLi2SO3 B�����Ϊ��صĸ�����ʯī����ص�����
C���õ���ڻ���Ӧ������ˮ����������Ӱ���ص�����
D����ع���ʱ����ṩ�ĵ��ӵ����ʵ���������������ʵ���֮����4��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ������ʡ�����и�����һ���ʼ컯ѧ�Ծ��������棩 ���ͣ������
1��һ������﮵���ǽ���ѧʽΪLi4Ti5O12��������Ϊ��ص��������ϣ��ڷŵ�Ĺ����б�Ϊ��ѧʽΪLi4Ti5O12�����ʡ�
��Li4Ti5O12��TiԪ�صĻ��ϼ�Ϊ ��﮵�ص�ͻ���ŵ��� ��
�ڸ�﮵����һ�ֶ��ε�أ��ŵ�ʱ�ĸ�����ӦʽΪ �����ʱ��������ӦʽΪ ��
��2����������ԭ�ζ����ⶨ�Ʊ��õ���TiO2�����е�TiO2��������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+������KSCN��Һ��Ϊָʾ������NH4Fe��SO4��2����Һ�ζ�Ti3+��ȫ������Ti4+��
��TiCl4ˮ������TiO2��xH2O�Ļ�ѧ����ʽΪ ��
�ڵζ��յ�������� ��
�۵ζ�����ʱ����ȡTiO2����0��2g������0.1mol��L-1 NH4Fe��SO4��2����Һ20ml����TiO2����������Ϊ____ ��
�����ڵζ��յ㣬��ȡ�ζ��̶ܿ�ʱ�����ӱ���Һ��Һ�棬ʹ��ⶨ��� ���ƫ����ƫС������Ӱ�족��o
��3����֪��

��TiCl4��I��+4Na��l��=Ti��s��+4NaCl��s���ġ�H= KJ��mol-1��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com