
 用NA表示阿伏加德罗常数,下列说法正确的是( )
用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | ③⑤⑥ | B. | ③⑤ | C. | ②④ | D. | ③④⑤ |
分析 ①求出36g D2O的物质的量,然后根据重水中含10个电子来分析;
②Na2O2与水的反应为歧化反应;
③C10H22分子中含9条碳碳键和22条C-H 键;
④在标准状况下,CH2Cl2为液体;
⑤求出6.2g氧化钠和7.8g过氧化钠的物质的量,然后根据氧化钠和过氧化钠均由2个阳离子个一个阴离子构成来分析;
⑥求出28g 硅晶体的物质的量,然后根据1mol晶体硅中含4mol共价键来分析.
解答 解:①重水的摩尔质量为20g/mol,故36g D2O的物质的量为1.8mol,而重水中含10个电子,故1.8mol重水中含1.8NA个电子,故错误;
②Na2O2与水的反应为歧化反应,1mol过氧化钠转移1mol电子,故0.1mol过氧化钠转移0.1NA个电子,故错误;
③C10H22分子中含9条碳碳键和22条C-H 键,故0.1molC10H22分子中含3.1NA条共价键,故正确;
④在标准状况下,CH2Cl2为液体,故不能根据气体摩尔体积来计算其物质的量,故错误;
⑤6.2g氧化钠的物质的量为0.1mol,7.8g过氧化钠的物质的量也为0.1mol,而氧化钠和过氧化钠均由2个阳离子个一个阴离子构成,故0.1mol氧化钠和0.1mol过氧化钠中均含有0.3NA个离子,故正确;
⑥28g 硅晶体的物质的量为1mol,而1mol晶体硅中含4mol共价键,故含4NA条,故错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| A. | 101kPa时,2H2(g)+O2(g)═2H2O(g);△H=-QkJ•mol-1,则H2的燃烧热为$\frac{1}{2}$QkJ•mol-1 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| C. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)$?_{500℃,30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氢碘酸加到Fe(OH)3胶体中 Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 以惰性电极电解MgCl2溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+2OH-+Cl2↑ | |
| C. | 碳酸氢钙溶液中加少量烧碱 Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| D. | 向酸性FeSO4溶液中加H2O2溶液 2Fe2++H2O2+2H+═2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 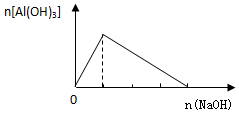 向AlCl3溶液中逐滴加入NaOH溶液 | |
| B. | 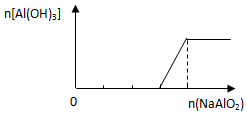 向稀盐酸中逐滴加入NaAlO2溶液 | |
| C. | 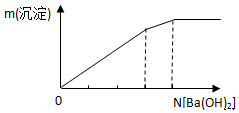 向明矾溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 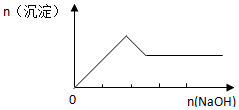 向Al2O3和Fe2O3的混合物中加入过量稀盐酸,向所得溶液中滴加NaOH的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应都有新物质生成 | |
| B. | 化学反应都伴随着能量的变化 | |
| C. | 化学反应都有电子的转移 | |
| D. | 化学反应的实质是旧化学键的断裂和新化学键的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加 Ba(OH)2溶液,产生大量沉淀 | |
| B. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生气体 | |
| C. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 | |
| D. | 加BaCl2溶液,没有沉淀,再加NaOH溶液,产生大量沉淀;最后加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类物质都有甜味,有甜味的物质都是糖类物质 | |
| B. | 蛋白质水解产物氨基酸可以合成人体所需蛋白质 | |
| C. | 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 | |
| D. | 食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要用途. | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com