
分析 ①同周期从左到右电负性越来越大;
②铜原子是29号,根据构造原理写出核外电子排布;
③Ac-表示醋酸根,配合物中配体都是分子,不带电,根据化合价代数和为零得出铜的化合价;
④根据中心原子的价层电子对数,确定杂化类型;两个原子间有且只有一条σ键;
⑤由均摊法计算氧化亚铜晶胞中Cu和O的数目,根据密度计算公式ρ=$\frac{m}{V}$计算即可.
解答 解:①同周期从左到右电负性越来越大,所以C、N、O的电负性由大到小的顺序为O>N>C,
故答案为:O>N>C;
②铜原子是29号,根据构造原理写出核外电子排布为1s22s22p63s23p63d104 s1或[Ar]3d104 s1,
故答案为:1s22s22p63s23p63d104 s1或[Ar]3d104 s1;
③Ac-表示醋酸根,配合物中配体都是分子,不带电,所以铜的化合价为+1价,
故答案为:+1;
④中心原子为碳,结合了1个氧原子,2个氮原子,且C无孤对电子,所以价层电子对为3对,故杂化轨道为sp2;每个碳的σ键为3条,每个亚氨基中σ键的数目2,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为7NA,
故答案为:sp2;7NA;
⑤O原子在晶胞的顶点和体心,故O原子数=8×$\frac{1}{2}$+1=2,Cu原子全部在体心,故Cu原子数=4,即一个氧化亚铜晶胞中有2个O原子和4个Cu原子,即2个Cu2O,则该氧化物的密度ρ=$\frac{m}{V}$=$\frac{144×2}{NA×(a×1{0}^{-10})^{3}}$=$\frac{288×1{0}^{30}}{{N}_{A}•{a}^{3}}$g•cm-3,
故答案为:$\frac{288×1{0}^{30}}{{N}_{A}•{a}^{3}}$.
点评 本题考查较为全面,涉及电子排布式、分子空间构型、杂化类型的判断以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法,题目难度中等.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:实验题
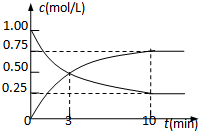 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
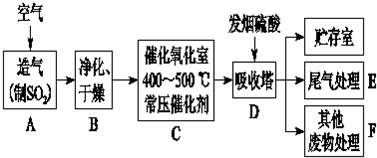
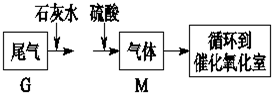
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 优等品 | 一等品 | 合格品 | |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热、冷却、称量,重复两次即是恒重操作 | |
| B. | 瓷坩埚加热后冷却时,必须放在干燥器中 | |
| C. | 加热晶体时先用小火,后渐改为用大火加热 | |
| D. | 加热时如晶体爆溅出坩埚,应再加一些晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2或CO2的大量排放都会导致酸雨的形成 | |
| B. | 氟氯烃等化合物的大量排放会破坏大气臭氧层 | |
| C. | 重金属、有机农药和工业废水的任意排放等会造成水体污染 | |
| D. | 装饰材料中的甲醛、苯和放射性元素氡等会造成居室污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| B. | 高锰酸钾溶液、酒精、过氧化钠都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| C. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| D. | PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康,这种颗粒物分散空气中形成胶体,它具有丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做好空气质量预报工作,以便空气污染时及时采取防护措施 | |
| B. | 推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油 | |
| C. | 将工业废水“再生”处理,用于道路保洁、城市喷泉和洗车等 | |
| D. | 利用风能、生物能发电,强制实施火力发电用煤的脱硫处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com