
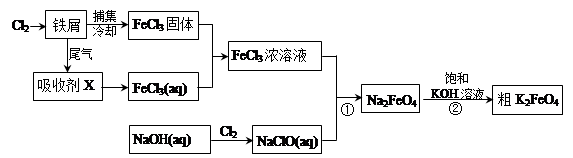
 K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
 Fe(OH)3 (胶体) + 3H+ ②氧化
Fe(OH)3 (胶体) + 3H+ ②氧化 K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因K2FeO4的溶解度比Na2FeO4小而溶液中K+、FeO42-的浓度比较大。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因K2FeO4的溶解度比Na2FeO4小而溶液中K+、FeO42-的浓度比较大。

 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢氟酸具有强酸性,可用于雕刻玻璃 |
| B.氨气显碱性,可用P2O5或无水CaCl2干燥 |
| C.MgO、Al2O3熔点高,它们都可用于制作耐火材料 |
| D.铜的活动性比铁弱,可在海轮外壳装铜块减缓海轮腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
| B.硅酸盐NaAlSiO4·nH2O可改写成氧化物形式为:Na2O·Al2O3·2SiO2·2nH2O |
| C.Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属Al、Cu、Fe都大 |
| D.过量铁与浓硫酸加热反应可以得到氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铜和铁与FeCl3溶液构成的原电池中:Cu +2 Fe3+ = Cu2+ + 2Fe2+ |
| B.铁上镀锌时阴极析出6.5g锌,溶液中减少Zn2+数为0.1mol |
| C.在反应:4CuS + 5O2 = 2Cu2O + 4SO2中CuS既是氧化剂又是还原剂 |
| D.生铁与浓H2SO4加热反应可产生SO2和CO2气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.5 mol/L | B.3.0 mol/L |
| C.2.0 mol/L | D.1.0 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe2++SO42-
Fe2++SO42- Fe3+
Fe3+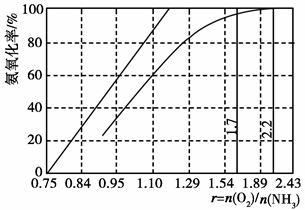
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com