
【题目】![]() 是制备电池的重要原料。室温下,
是制备电池的重要原料。室温下,![]() 溶液的pH随
溶液的pH随![]() 的变化如图甲所示,
的变化如图甲所示,![]() 溶液中
溶液中![]() 的分布分数
的分布分数![]() 随pH的变化如图乙所示
随pH的变化如图乙所示 。
。

下列有关![]() 溶液的叙述正确的是
溶液的叙述正确的是 ![]()
![]()
A.溶液中存在3个平衡
B.含P元素的粒子有![]() 、
、![]() 和
和![]()
C.随![]() 增大,溶液的pH明显变小
增大,溶液的pH明显变小
D.用浓度大于![]() 的
的![]() 溶液溶解
溶液溶解![]() ,当pH达到
,当pH达到![]() 时,
时,![]() 几乎全部转化为
几乎全部转化为![]()
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】常温下,在![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示
溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示![]() 因逸出未画出,忽略因气体逸出引起的溶液体积变化
因逸出未画出,忽略因气体逸出引起的溶液体积变化![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()
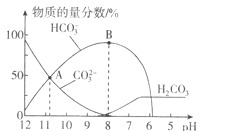
A.在![]() 溶液中:
溶液中:![]()
B.当溶液的pH为7时,溶液的总体积为![]()
C.在B点所示的溶液中,离子浓度最大的是![]()
D.在A点所示的溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
CO2(g)+H2(g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A.升高温度,K增大B.减小压强,n(CO2)增加
C.更换高效催化剂,α(CO)增大D.充入一定量的氮气,n(H2)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1molL-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1molL-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图。下列说法不正确的是( )

A.NaX溶液呈碱性B.P点:c(Na+)>c(H+)
C.M点:c(HX)+c(X-)=2c(Na+)D.M点水电离程度小于N点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常借助曲线图来表示某种变化过程,有关下列四个曲线图的说法不正确的是( )

A.对反应:aA(s)+2B(g) ![]() xC(g),根据图①可以求出x=2
xC(g),根据图①可以求出x=2
B.图②可以表示对某化学平衡体系改变温度后反应速率随时间的变化
C.图③表示压强对可逆反应2A(g)+2B(g) ![]() 3C(g)+D(g)的影响,乙的压强大
3C(g)+D(g)的影响,乙的压强大
D.升高温度,图④表示的反应中反应物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | AG=lg[ | NH4+、Fe2+、I﹣、NO3- | 一定能大量共存 |
C | pH=1的溶液 | Fe2+、Al3+、 SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所下列化学用语的理解正确的是( )
A.比例模型![]() 既可以表示甲烷分子,也可以表示四氯化碳分子
既可以表示甲烷分子,也可以表示四氯化碳分子
B.电子式![]() H既可以表示羟基,也可以表示氢氧根离子
H既可以表示羟基,也可以表示氢氧根离子
C.丙烯的最简式可表示为CH2
D.结构简式(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是

A.整个过程中两电极反应2Cl--2e-=Cl2↑、2H++2e-=H2↑不可能同时发生
B.电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度
C.ab段表示电解过程中H+被还原,pH上升
D.原混合溶液中KCl和CuSO4的浓度之比恰好为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某浓度的H2C2O4溶液中逐滴加入已知浓度的NaOH溶液,若定义pc是溶液中溶质的物质的量浓度的负对数,则所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)与溶液pH的关系如图所示(已知:H2C2O4HC2O4-+H+ Ka1;HC2O4- C2O42-)+H+ Ka2)。则下列说法正确的是( )
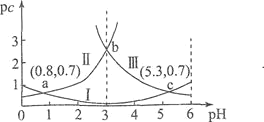
A.pH=4时,c(HC2O4-)<c(C2O42-)
B.常温下,Ka1=10-0.7
C.pH=3~5.3的过程中水的电离程度增大
D.常温下,![]() 随pH的升高先增大后减小
随pH的升高先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com