
| A. | 2-甲基-2-氯丙烷 | B. | 2-甲基-3-氯戊烷 | ||
| C. | 2,2-二甲基-1-氯丁烷 | D. | 1,3-二氯苯 |
分析 能发生消去反应生成两种烯烃,说明该分子结构不对称;能发生水解反应,说明还含有酯基或卤原子,据此分析解答.
解答 解:A.2-甲基-2-氯丙烷结构简式为CH3C(CH3)ClCH3,该物质发生消去反应生成一种烯烃,故A错误;
B.2-甲基-3-氯戊烷结构简式为CH3CH(CH3)CHClCH2CH3,该分子结构不对称,发生消去反应生成两种烯烃,且能发生水解反应,故B正确;
C.2,2-二甲基-1-氯丁烷结构简式为ClCH2C(CH3)2CH2CH3,该物质发生消去反应生成一种烯烃,故C错误;
D.1,3-二氯苯不能发生消去反应,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确常见物质官能团及其性质关系、常见反应类型等即可解答,注意:只有连接氯原子的碳原子相邻碳原子上含有氢原子的卤代烃才能发生消去反应,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、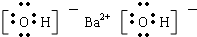 .
.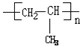 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漏斗 | B. | 玻璃棒 | C. | 烧杯 | D. | 容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
| A. | 当通入Cl2的体积为2.8L时,只有I-与Cl2发生反应 | |
| B. | 当通入Cl2的体积为2.8-5.6L时,只有Br-与Cl2发生反应 | |
| C. | a=0.15 | |
| D. | 原溶液中c(Cl-):c(Br-):c(I-)=10:15:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com