
【题目】如表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)④、⑥的元素符号分别是_____、______
(2)⑨元素氢化物的电子式是________
(3)⑧元素的原子结构示意图是__________
(4)元素①-⑨中原子半径最大的是_____;
(6)在盛有水的小烧杯中加入元素⑤的单质,发生反应的离子方程式为______;向上述反应后的溶液中加入元素⑥的单质,发生反应的化学方程式为______。
【答案】O Al 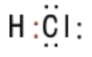
 Na Al(OH)3 2Na+2H2O=2Na ++2OH-+H2↑ 2Al+2H2O+2NaOH=2NaAlO2+3H2↑
Na Al(OH)3 2Na+2H2O=2Na ++2OH-+H2↑ 2Al+2H2O+2NaOH=2NaAlO2+3H2↑
【解析】
由元素在周期表位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl。
(1)由分析可知,④、⑥的元素符号分别是O、Al;
(2)⑨为Cl,氯化氢属于共价化合物,氢原子最外层电子与Cl最外层电子形成一对共用电子对,其电子式是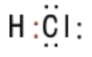 ;
;
(3)⑧为S,原子结构示意图是 ;
;
(4)同周期元素,从左往右,原子半径逐渐减小。同主族元素,从上往下,原子半径逐渐增大。则元素①-⑨中原子半径最大的是Na;
(5)最高价氧化物对应的水化物Al(OH)3既能与强酸又能与强碱反应,为两性氢氧化物;
(6)⑤为Na,在盛有水的小烧杯中加入Na单质,钠与水反应生成氢氧化钠和氢气,发生反应的离子方程式为2Na+2H2O=2Na ++2OH-+H2↑;向上述反应后的溶液中加入Al单质,铝与氢氧化钠和水反应生成偏铝酸钠和氢气,发生反应的化学方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑。


科目:高中化学 来源: 题型:
【题目】某硫原子的质量是ag,12C原子的质量是bg,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为![]() ②mg该硫原子的物质的量为
②mg该硫原子的物质的量为![]() mol
mol
③该硫原子的摩尔质量是aNA g ④ag该硫原子所含的电子数为16NA
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液。生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+ CH3OCOOCH3(g)![]() 2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )
2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )

A.该反应△H > 0
B.R1对应的反应物配比为3:1
C.650℃,反应物配比为1:1时,平衡常数K = 6
D.该反应为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①R-NO2![]() R-NH2;②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯作原料制备一系列化合物的转化关系图:
R-NH2;②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是______________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①②物质的结构简式:①__________,②_______。
(3)苯的二氯代物有________种同分异构体。
(4)有机物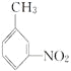 的所有原子________(填“是”或“不是”)在同一平面上。
的所有原子________(填“是”或“不是”)在同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.重铬酸钾(K2Cr2O7)是一种强氧化剂,在实验室和工业中都有很广泛的应用。同时,由于其具有致癌作用,也是环境污染物之一,必须进行处理。工业上通常以铬铁矿(主要成分为FeO·Cr2O3,另外还含有SiO2、Al2O3等杂质)为原料制备重铬酸钾,主要流程如下图所示:
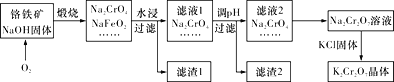
已知:①NaFeO2遇水强烈水解,生成红褐色物质;
②2CrO42- (黄色)+2H+![]() Cr2O72- (橙色)+H2O。
Cr2O72- (橙色)+H2O。
请回答下列问题:
(1)滤液1的溶质除Na2CrO4、Na2SiO3外,还含有________________(填化学式);
(2)由滤液2转化为Na2Cr2O7溶液过程中,能说明反应达平衡状态的是________(填字母代号);
a.溶液的颜色不变
b.v(CrO![]() )=2v(Cr2O
)=2v(Cr2O![]() )
)
c.Cr2O![]() 和CrO
和CrO![]() 的浓度相同
的浓度相同
(3)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是加热浓缩、______________、过滤、洗涤、干燥。
Ⅱ.工业废水中常含有一定量的Cr2O![]() 和CrO
和CrO![]() ,常用还原沉淀法处理。该方法的工艺流程为:
,常用还原沉淀法处理。该方法的工艺流程为:
CrO![]()
![]() Cr2O
Cr2O![]()
![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
(4)请写出Cr2O![]() 与FeSO4溶液在酸性条件下反应的离子方程式:______________________。
与FeSO4溶液在酸性条件下反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:①16H++10Z-+2![]() ===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
===2X2++5Z2+8H2O,②2M2++R2===2M3++2R-,③2R-+Z2===R2+2Z-,由此判断下列说法错误的是( )
A.氧化性强弱顺序为:![]() <Z2<R2<M3+
<Z2<R2<M3+
B.还原性强弱顺序为:X2+<Z-<R-<M2+
C.Z元素在反应①中被氧化,在③中被还原
D.常温下可发生反应2M2++Z2===2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A. 3.0g甲醛和乙酸的混合物中所含的原子数为![]()
B. ![]() 与
与![]() 充分反应,转移的电子数为
充分反应,转移的电子数为![]()
C. ![]() 的稀硫酸中含有的氢离子数目为
的稀硫酸中含有的氢离子数目为![]()
D. 4.6g有机物![]() 的分子结构中碳氢键数目一定为
的分子结构中碳氢键数目一定为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据不完全统计,全世界每年约有10%~20%的农副产品,水产品会因腐败变质而无法食用,经济损失巨大,所以研究安全无害的食品防腐剂很重要,山梨酸及其盐,尼泊金酯等可作为食品防腐剂,其结构简式如图:
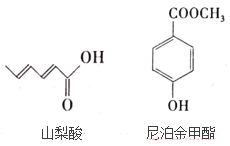
按要求回答下列问题:
(1)写出山梨酸中含氧官能团的名称___。
(2)常温下,等物质的量的山梨酸、尼泊金甲酯分别与足量溴水反应,消耗Br2的物质的量之比为___。
(3)写出尼泊金甲酯与NaOH溶液反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:
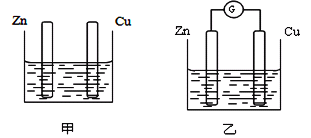
(1)以下叙述中,正确的是________(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中SO42-向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为________;乙为____________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_______________________ 。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应式__________________。当电路中转移0.2 mol电子时,消耗负极材料的质量为_________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com