
【题目】下列各组物质互为同系物的是( )
A. 硬脂酸和软脂酸 B. 乙酸和油酸
C. C6H5—CH2OH和C6H5—OH D. 丙酸丙酯和硬脂酸甘油酯
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 30 g乙烷中所含的极性共价键数为7NA
B. 标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA
C. 1 L浓度为1 mol·L-1的 H2O2水溶液中含有的氧原子数为2NA
D. MnO2和浓盐酸反应生成1 mol氯气时,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C 为中学常见单质,其中一种为金属;通常情况下,A 为固体,B 为液体,C 为气体。D、 E、F、G、H、X 均为化合物,其中 X 是一种无氧强酸、E 为黑色固体,H 在常温下为液体。它们之间的 转化关系如图所示(其中某些反应条件和部分反应物已略去)。

(1)写出化学式:A____________、D__________、E__________、X________。
(2) 在反应①~⑦中,不属于氧化还原反应的是__________(填编号)。
(3) 反应⑥的离子方程式为__________。
(4)反应⑦的化学方程式为__________,该反应中每消耗 0.3molA,可转移电子__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1. 6mol Fe,充分反应(已知NO![]() 被还原为NO)。下列说法正确的是( )
被还原为NO)。下列说法正确的是( )
A. 被还原的硝酸是1.25mol
B. 所得溶液中c(Fe2+)∶c(Fe3+)=1∶1
C. 所得溶液中n(NO3-)=2.75 ,该溶液含还可溶解铁0.375mol.
D. 所得溶液中的溶质只有FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)已知X,Y,Z,W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。
(1)Z离子的结构示意图是 。
(2)X、Y、W可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是 ,其中含有的化学键有 。
(3)X与Y所形成的分子的电子式为 ,它比同主族其他元素的氢化物沸点高的原因是 。
(4)请设计一个简单的实验,说明Z、W两种元素非金属性的强弱,写出实验方法和现象: ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造。以镍粉废料为原料制备Ni2O3的工艺如下:

回答下列问题:
(1)Ni2O3中Ni的化合价为___________________________________。
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是_________________________。
(3)加入H2O2“氧化”的离子方程式为_________________________________________;滤渣A的主要成分是________________(填化学式)。
(4)工艺中分步加入Na2CO3的作用是________________________________;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡结构松散,不能用于制造器皿;而白锡结构坚固,可以制造器皿。己知0℃、101 kPa时Sn(白,s)=Sn(灰,s)△H= -2180.9 J·mol-1,△S=- 6.61 J·mol-1·K-1。假设△H和△S不随温度的改变而改变,现把白锡制造的器皿放在室温下存放,它会不会变成灰锡而不能继续使用 ( )
A. 会变 B. 不会变 C. 不能确定 D. 升高温度才会变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是( )
A.①③②④B.①③④②
C.③④②①D.③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂综合处理含 NH4+废水和工业废气(主要含 N2、CO2、SO2、NO、CO,不考虑其他成分),设计的流程如下图,回答下列问题:
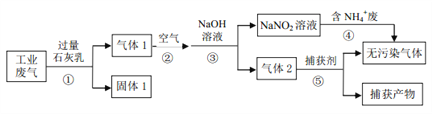
(1)固体 1的主要成分有______(填化学式)。
(2)反应①需控制反应的温度和气体的流速,其共同目的是______。
(3)反应④的离子方程式为______。
(4)已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O
在同温同压下,当反应②中NO与空气的体积比为______,经反应③,气体中NOx被完全吸收且仅生成 NaNO2。(设空气中氧气所占体积分数为 0.2)
(5)CuCl 的氨溶液常用作反应⑤的捕获剂。将(NH4)2SO3、NH4Cl与CuSO4 3种溶液相混可制得难溶物 CuCl。
① 理论上,(NH4)2SO3与CuSO4恰好反应时,n(SO32-):n(Cu2+)=______。
② 实际上, (NH4)2SO3的用量与 Cu2+的沉淀率关系如图所示,显然Cu2+沉淀率最高时,(NH4)2SO3的用量高于理论值其原因是______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com