
(本题8分)汽车尾气是造成雾霾天气的重要原因之一。已知:
①N2(g)+O2(g)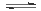 2NO(g) ΔH1 ②2NO(g)+O2(g)
2NO(g) ΔH1 ②2NO(g)+O2(g)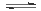 2NO2(g) ΔH2
2NO2(g) ΔH2
③CO2(g)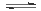 CO(g)+1/2O2(g) ΔH3 ④2CO(g)+2NO(g)
CO(g)+1/2O2(g) ΔH3 ④2CO(g)+2NO(g)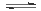 N2(g)+2CO2(g) ΔH4
N2(g)+2CO2(g) ΔH4
请完成以下问题:
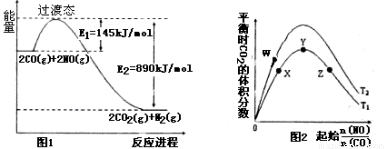
(1)请根据反应①②③,确定反应④中ΔH4= 。
(2)根据图1,反应④的热化学方程式为: 。
该反应在 (填“高温”“低温”或“任意温度”)下有利于该反应正向自发。
(3)图2表示反应④的反应物NO、CO的起始物质的量比、温度对平衡时CO2的体积分数的影响。
①W、Y、Z三点的平衡常数的大小关系为: , X、Y、Z三点,CO的转化率由大到小的顺序是 。
②T1℃时,在1L密闭容器中,0.1molCO和0.1molNO,达到Y点时,测得NO的浓度为0.02mol/L,则此温度下平衡常数K= (算出数值)。若此温度下,某时刻测得CO、NO、N2、CO2的浓度分别为0.01 mol/L、a mol/L、0.01 mol/L、0.04 mol/L,要使反应向正方向进行,a的取值范围为 。
(4)恒温恒容时,反应④中NO、CO按一定比例投料,反应过程中CO浓度随时间的变化关系如图3所示,请在同一图中绘出N2浓度随时间的变化曲线。
(1)ΔH4 =-ΔH1-2ΔH3(1分)
(2)2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH4 =-745KJ/mol(1分) 低温(1分)
N2(g)+2CO2(g) ΔH4 =-745KJ/mol(1分) 低温(1分)
(3)①Kw>Ky=Kz(1分) Z>Y>X (1分) ②K=1600(1分) a>0.01(1分)
(4)
【解析】
试题分析:(1)①N2(g)+O2(g)?2NO(g)△H1 ②2NO(g)+O2(g)?2NO2(g)△H2 ③CO2(g)?CO(g)+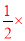 O2(g)△H3依据盖斯定律计算③×2+①得到N2(g)+2CO2(g)=2CO(g)+2NO(g)△H=△H1+2△H3;改变反应方向得到反应④的热化学方程式为:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H4 =-△H1-2△H3;故答案为:-△H1-2△H3;(2)图象分析,反应是放热反应,反应的焓变△H=E1-E2=145KJ/mol-890KJ/mol=-745KJ/mol,热化学方程式为:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-745KJ/mol;反应是放热反应,△H<0,△S<0,低温下△H-T△S<0;故答案为:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-745KJ/mol;低温;(3)①图象分析,反应物NO、CO的起始物质的量比一定,反应是放热反应,温度越高平衡逆向进行,二氧化碳体积分数减小,T1>T2;温度一定,随反应物NO、CO的起始物质的量比增大,X-Y反应正向进行,一氧化碳的转化率X<Y,Y-Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z,X、Y、Z三点,CO的转化率的从大到小的顺序Z>Y>X;故答案为:>;Z>Y>X;②T1℃时,在1L的密闭容器中,充入0.1mol CO和0.1mol NO,达到Y点时,测得NO的浓度为0.02mol?L-1,
O2(g)△H3依据盖斯定律计算③×2+①得到N2(g)+2CO2(g)=2CO(g)+2NO(g)△H=△H1+2△H3;改变反应方向得到反应④的热化学方程式为:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H4 =-△H1-2△H3;故答案为:-△H1-2△H3;(2)图象分析,反应是放热反应,反应的焓变△H=E1-E2=145KJ/mol-890KJ/mol=-745KJ/mol,热化学方程式为:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-745KJ/mol;反应是放热反应,△H<0,△S<0,低温下△H-T△S<0;故答案为:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H=-745KJ/mol;低温;(3)①图象分析,反应物NO、CO的起始物质的量比一定,反应是放热反应,温度越高平衡逆向进行,二氧化碳体积分数减小,T1>T2;温度一定,随反应物NO、CO的起始物质的量比增大,X-Y反应正向进行,一氧化碳的转化率X<Y,Y-Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z,X、Y、Z三点,CO的转化率的从大到小的顺序Z>Y>X;故答案为:>;Z>Y>X;②T1℃时,在1L的密闭容器中,充入0.1mol CO和0.1mol NO,达到Y点时,测得NO的浓度为0.02mol?L-1,
2CO(g)+2NO(g)?N2(g)+2CO2(g)
起始量(mol/L) 0.1 0.1 0 0
变化量(mol/L) 0.08 0.08 0.04 0.08
平衡量(mol/L) 0.02 0.02 0.04 0.08
则此温度下平衡常数K=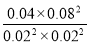 =1600,某时刻测得CO、NO、N2、CO2的浓度分别为0.01mol?L-1、a mol?L-1、0.01mol?L-1、0.04mol?L-1,要使反应向正方向进行Q<K=1600,Q=
=1600,某时刻测得CO、NO、N2、CO2的浓度分别为0.01mol?L-1、a mol?L-1、0.01mol?L-1、0.04mol?L-1,要使反应向正方向进行Q<K=1600,Q=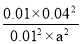 <1600,a>0.01
<1600,a>0.01
考点:化学平衡的有关计算


科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:选择题
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
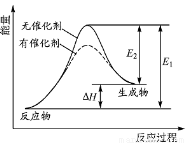
A.该反应为放热反应
B.催化剂能改变反应的焓变
C.催化剂能降低反应的活化能
D.逆反应的活化能大于正反应的活化能
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关,下列有关说法正确的是
A.腌制火腿时,添加少量NaNO2,是为了使火腿肉的味道更加美味可口
B.溴化银是重要感光材料,可用于人工降雨
C.任何元素的原子都是由核外电子和核内中子、质子组成的
D.分类方法、定量研究、实验方法等是化学研究的常用方法
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:选择题
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) ΔH<0如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
2Z(g) ΔH<0如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
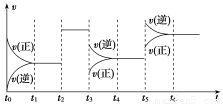
下列说法中正确的是
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内转化率最低
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:选择题
下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合中,正确的是
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
B | 冰醋酸 | 福尔马林 | 苛性钾 | HI | 乙醇 |
C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
D | 胆矾 | 石灰水 | 硫酸钡 | HNO2 | NH3 |
查看答案和解析>>
科目:高中化学 来源:2014秋河北省高二上学期期中化学试卷(解析版) 题型:选择题
在下图装置中,若通电一段时间后乙装置左侧电极质量增加,下列说法错误的是
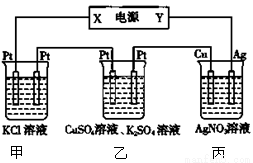
A.当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g
B.电解过程中装置丙的pH无变化
C.丙中硝酸银溶液的浓度不变
D.乙中左侧电极反应式:Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源:2014秋河北省高二上学期期中化学试卷(解析版) 题型:选择题
下图是关于反应A2(g)+3B2(g) 2C(g) △H<0的平衡移动图形,影响平衡移动的原因是
2C(g) △H<0的平衡移动图形,影响平衡移动的原因是
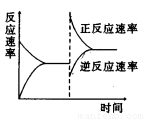
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时使用催化剂
D.增大反应物浓度,同时减小生成物浓度
查看答案和解析>>
科目:高中化学 来源:2014秋江苏省东台市高二第一学期期中考试化学试卷(解析版) 题型:填空题
(12分)合成口服抗菌药琥乙红霉素片的原料G、某种广泛应用于电子领域的高分子化合物I的合成路线如下:
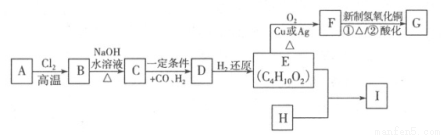
已知:① R—CH2—CH=CH2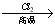 R—CHCl—CH=CH2
R—CHCl—CH=CH2
②R—CH2—CH=CH2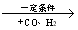 R—CH2CH2CH2CHO
R—CH2CH2CH2CHO
(1)C的结构简式是 ,E中的官能团的名称是 。
(2)写出A→B的反应方程式 ,该反应类型是 。
(3)H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯取代物只有一种,试写出
E+H→I的反应方程式 ,该反应类型是 。
(4)关于G的说法中错误的是 (填序号)。
A.1 mol G最多可与2 mol NaHCO3反应
B.G可发生消去反应
C.1 mol G最多可与2 mol H2发生加成反应
D.1 mol G在一定条件下可与2 mol乙醇发生取代反应
查看答案和解析>>
科目:高中化学 来源:2014秋江苏省东台市高一第一学期期中考试化学试卷(解析版) 题型:选择题
两种元素原子X和Y,Y原子的第三层比氩原子的第三层少6个电子,Y原子的第二层电子数恰为X原子第二层电子数的2倍,则X、Y的质子数分别为
A.14和12 B.6和12 C.12和6 D.8和12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com