
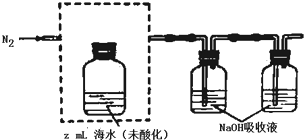
分析 (1)①由题意可知,需从酸化后的海水中吹出二氧化碳,那么需要滴加酸将其酸化,且吹出的气体中不能含有与NaOH反应的气体,装置中导气管应从遵循“长进短出”原则;
②依据原理NaHCO3+HCl=NaCl+CO2↑+H2O计算二氧化碳;
(2)酸的电离平衡常数越小,其对应的酸根离子水解程度越大,则相同浓度的钠盐溶液的pH越高;
根据电离平衡常数知,酸的电离平衡常数大小顺序是:H2SO3>HSO3->H2CO3>HCO3-,则酸根离子水解程度大小顺序是CO32->HCO3->SO32->HSO3-,这些弱酸根离子都水解但程度都较小,据此判断.
解答 解:(1)①酸化海水,利用氮气将二氧化碳吹出,且吹出的气体中不能含有与NaOH反应的气体,所以选用稀硫酸,且装置中导气管遵循“长进短出”原则,利用分液漏斗滴加,长管进气,短管出气,故装置为: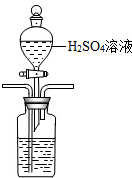 ,
,
故答案为: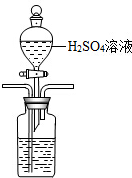 ;
;
②此反应原理为:NaHCO3+HCl=NaCl+CO2↑+H2O,即碳酸氢钠与盐酸的物质的量之比为1:1,那么海水中碳酸氢钠的浓度为c,体积均为mL,依据题意有c×z=xy,解c=$\frac{xy}{z}$mol/L,故答案为:$\frac{xy}{z}$;
(2)酸的电离平衡常数越小,其对应的酸根离子水解程度越大,则相同浓度的钠盐溶液的pH越高,电离平衡常数HSO3->HClO,所以水解程度ClO->SO32-,所以相同温度下0.1mol/L NaClO溶液的pH大于0.1mol/L Na2SO3溶液的pH;
根据电离平衡常数知,酸的电离平衡常数大小顺序是:H2SO3>HSO3->H2CO3>HCO3-,则酸根离子水解程度大小顺序是CO32->HCO3->SO32->HSO3-,这些弱酸根离子都水解但程度都较小,所以离子浓度大小顺序是SO32->CO32->HCO3->HSO3-,
故答案为:大于;SO32->CO32->HCO3->HSO3-.
点评 本题考查弱电解质的电离、中和滴定实验等知识点,为高频考点,明确实验原理、酸的电离平衡常数与酸根离子水解程度关系是解本题关键,注意:CO32-对应的酸是HCO3-而不是H2CO3,SO32-对应的酸是HSO3-而不是H2SO3,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铯的碱性非常强 | |
| B. | 碱金属单质中铯的沸点最低 | |
| C. | 将一小块铯投入水中,实验现象与钠和水反应的完全相同 | |
| D. | 铯可以与很多非金属反应,形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
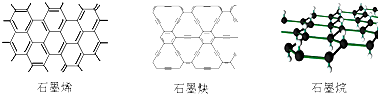
| A. | 石墨烯、石墨炔和石墨烷互为同素异形体 | |
| B. | 12g石墨烯完全转变为石墨烷需氢气11.2L | |
| C. | 石墨炔可作半导体材料,有望替代二氧化硅 | |
| D. | 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
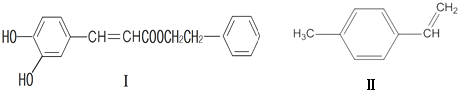
 或
或 (写1种);由Ⅳ生成Ⅱ的反应条件为NaOH的醇溶液、加热.
(写1种);由Ⅳ生成Ⅱ的反应条件为NaOH的醇溶液、加热.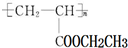 可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.
可用于制备涂料,其单体结构简式为CH2=CHCOOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素原子序数为29.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素原子序数为29. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成40.0LN2(标况) | B. | 有0.250molKNO3被氧化 | ||
| C. | 共生成0.625mol氧化物 | D. | 共转移电子1.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 mol | B. | 7 mol | C. | 6 mol | D. | 8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种物质中一定有共价化合物 | B. | 四种物质中一定有Ba(OH)2 | ||
| C. | 丙溶液加热蒸干可得原无水溶质 | D. | 丁溶液中含有HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热44kJ | B. | 吸热2.44KJ | C. | 放热44kJ | D. | 放热2.44KJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com