
”¾ĢāÄæ”æøßĀČĖįČżĢ¼õ£ėĀŗĻÄų{[Ni(CHZ)3](ClO4)2}ŹĒŅ»ÖÖŠĀŠĶµÄĘš±¬Ņ©”£
£Ø1£©Š“³ö»łĢ¬NiŌ×ÓµÄĶāĪ§µē×ÓÅŲ¼Ķ¼___”£
£Ø2£©NiÄÜÓėCOŠĪ³ÉÅäŗĻĪļNi(CO)4£¬ÅäĢåCOÖŠĢį¹©¹Āµē×Ó¶ŌµÄŹĒCŌ×Ó¶ų²»ŹĒOŌ×Ó£¬ĘäĄķÓÉæÉÄÜŹĒ___£»1moløĆÅäŗĻĪļ·Ö×ÓÖŠ¦Ņ¼üŹżÄæĪŖ___£ØÉčNAĪŖ°¢·üŁ¤µĀĀŽ³£ŹżµÄÖµ£¬ĻĀĶ¬£©”£
£Ø3£©¢ŁClO4-µÄVSEPRÄ£ŠĶŹĒ___”£
¢ŚŠ“³öÓėClO4-»„ĪŖµČµē×ÓĢåµÄŅ»ÖÖ·Ö×Ó£ŗ___(Ģī»ÆѧŹ½)”£
£Ø4£©øßĀČĖįČżĢ¼õ£ėĀŗĻÄų»ÆѧŹ½ÖŠµÄCHZĪŖĢ¼õ£ėĀ£¬Ęä½į¹¹ĪŖ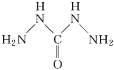 £¬ĖüŹĒŅ»ÖÖŠĀŠĶµÄ»·±£¹ųĀÆĖ®³żŃõ¼Į”£Ģ¼õ£ėĀÖŠµŖŌ×ÓŗĶĢ¼Ō×ÓµÄŌӻƹģµĄĄąŠĶ·Ö±šĪŖ___”¢___”£
£¬ĖüŹĒŅ»ÖÖŠĀŠĶµÄ»·±£¹ųĀÆĖ®³żŃõ¼Į”£Ģ¼õ£ėĀÖŠµŖŌ×ÓŗĶĢ¼Ō×ÓµÄŌӻƹģµĄĄąŠĶ·Ö±šĪŖ___”¢___”£
£Ø5£©øßĀČĖįČżĢ¼õ£ėĀŗĻÄųæÉÓÉNiO”¢øßĀČĖį¼°Ģ¼õ£ėĀ»ÆŗĻ¶ų³É”£
¢ŁøßĀČĖįµÄĖįŠŌĒæÓŚ“ĪĀČĖįµÄŌŅņŹĒ___”£
¢ŚČēĶ¼ĪŖNiO¾§°ū£¬Ōņ¾§ĢåÖŠNi2+µÄÅäĪ»ŹżĪŖ___£»Čō¾§°ūÖŠNi2+¾ąĄė×ī½üµÄO2-Ö®¼äµÄ¾ąĄėĪŖapm£¬ŌņNiO¾§ĢåµÄĆܶČ=___g”¤cm-3£ØÓĆŗ¬a”¢NAµÄ“śŹżŹ½±ķŹ¾£©”£
”¾“š°ø”æ![]() µēøŗŠŌO£¾C£¬OŌ×Ó²»Ņ×Ģį¹©¹Āµē×Ó¶Ō 8NA ÕżĖÄĆęĢå CCl4 sp3 sp2 ·ĒōĒ»łŃõµÄøöŹżŌ½¶ą£¬ClµÄÕżµēŠŌŌ½øߣ¬µ¼ÖĀCl©O©HÖŠOµÄµē×ÓŌ½ĻņClĘ«ŅĘ£¬Ō½ČŻŅ×µēĄė³öH+ 6
µēøŗŠŌO£¾C£¬OŌ×Ó²»Ņ×Ģį¹©¹Āµē×Ó¶Ō 8NA ÕżĖÄĆęĢå CCl4 sp3 sp2 ·ĒōĒ»łŃõµÄøöŹżŌ½¶ą£¬ClµÄÕżµēŠŌŌ½øߣ¬µ¼ÖĀCl©O©HÖŠOµÄµē×ÓŌ½ĻņClĘ«ŅĘ£¬Ō½ČŻŅ×µēĄė³öH+ 6 ![]()
”¾½āĪö”æ
(1)NiŌŖĖŲŌ×ÓŗĖĶāÓŠ28øöµē×Ó£¬Ō×ÓŗĖĶāµē×ÓÅŲ¼ĪŖ1s22s22p63s23p63d84s2£»
(2)µēøŗŠŌŌ½“ó£¬Ō×ÓŌ½²»Ņ×Ģį¹©¹Āµē×Ó¶Ō£»NiŌ×ÓŠĪ³ÉµÄ4øöÅäĪ»¼üŹōÓŚ¦Ņ¼ü£¬COÓėN2»„ĪŖµČµē×ÓĢ壬CO·Ö×Ó½į¹¹Ź½ĪŖC”ŌO£¬CO·Ö×ÓÖŠŗ¬ÓŠ1øö¦Ņ¼ü”¢2øö¦Š¼ü£»
(3)¢Ł1molClO4©Ąė×ÓÖŠÓŠ4mol¦Ņ¼ü£»
¢ŚŌ×Ó×ÜŹżĻąĶ¬”¢¼Ū²ćµē×Ó¶Ō×ÜŹżĻąµČµÄĮ£×Ó»„ĪŖµČµē×ÓĢ壻
(4)Ģ¼õ£ėĀÖŠµŖŌ×ÓÓŠŅ»¶Ō¹Āµē×Ó¶ŌĒŅŠĪ³É3øö¦Ņ¼ü£¬Ģ¼Ō×ÓŠĪ³É3øö¦Ņ¼ü£»
(5)¢Ł·ĒōĒ»łŃõŹżÄæŌ½¶ą£¬ÖŠŠÄŌŖĖŲµÄÕżµēŠŌŌ½øߣ¬Ō½ČŻŅ×µēĄė³öĄė×Ó£»
¢ŚŅŌ¶„µćNi2+ĪŖ²ĪÕÕ£¬ĘäÖÜĪ§µČ¾ąĒŅ×ī½üµÄŃõĄė×Ó“¦ÓŚĄāŠÄ£»ÓÉNi2+¾ąĄė×ī½üµÄO2©Ö®¼äµÄ¾ąĄėæɼĘĖć¾§°ū²ĪŹż£¬Óɾ§°ū²ĪŹż¼ĘĖć¾§°ūĢå»żV£¬ÓɾłĢƷؼĘĖć¾§°ūÖŠNi2+ŗĶO2©µÄŹżÄ棬æɼĘĖć¾§°ūÖŹĮæm£¬øł¾Ż¾§ĢåĆÜ¶Č¦Ń£½![]() ¼ĘĖć”£
¼ĘĖć”£
(1)NiŌŖĖŲŌ×ÓŗĖĶāÓŠ28øöµē×Ó£¬Ō×ÓŗĖĶāµē×ÓÅŲ¼ĪŖ1s22s22p63s23p63d84s2£¬ĶāĪ§µē×ÓÅŲ¼Ķ¼ĪŖ![]() £»
£»
(2)µēøŗŠŌO£¾C£¬OŌ×Ó²»Ņ×øų³ö¹Āµē×Ó¶Ō£¬ÅäĢåCOÖŠĢį¹©¹Āµē×Ó¶ŌµÄŹĒCŌ×Ó”£NiŌ×ÓŠĪ³ÉµÄ4øöÅäĪ»¼üŹōÓŚ¦Ņ¼ü£¬COÓėN2»„ĪŖµČµē×ÓĢ壬CO·Ö×Ó½į¹¹Ź½ĪŖC”ŌO£¬CO·Ö×ÓÖŠŗ¬ÓŠ1øö¦Ņ¼ü”¢2øö¦Š¼ü£¬¹ŹNi(CO)4ÖŠŗ¬ÓŠ8øö¦Ņ¼ü”¢8øö¦Š¼ü£¬1 mol øĆÅäŗĻĪļ·Ö×ÓÖŠ¦Ņ ¼üŹżÄæĪŖ8NA£»
(3)¢Ł1molClO4©Ąė×ÓÖŠÓŠ4mol¦Ņ¼ü£¬ĘäŌӻƷ½Ź½ĪŖsp3£¬VSEPR Ä£ŠĶŹĒÕżĖÄĆęĢ壻
¢ŚŌ×Ó×ÜŹżĻąĶ¬”¢¼Ū²ćµē×Ó¶Ō×ÜŹżĻąµČµÄĮ£×Ó»„ĪŖµČµē×ÓĢ壬1molClO4©Ąė×ÓÓŠ5molŌ×Ó£¬¼Ūµē×ÓĪŖ32£¬ĘäµČµē×ÓĢåĪŖCCl4»ņSiF4µČ£»
(4)Ģ¼õ£ėĀÖŠµŖŌ×ÓÓŠŅ»¶Ō¹Āµē×Ó¶Ō£¬ĆæøöNŌ×ÓŠĪ³É3øö¦Ņ¼ü£¬¹ŹŌӻƷ½Ź½ĪŖsp3£®Ģ¼Ō×ÓŠĪ³É3øö¦Ņ¼ü£¬ŌӻƷ½Ź½ĪŖsp2£»
(5)¢ŁHClO4ÖŠ·ĒōĒ»łŃõŹżÄæ±ČHClOµÄ¶ą£¬HClO4ÖŠClµÄÕżµēŠŌøüøߣ¬µ¼ÖĀCl©O©HÖŠOµÄµē×ÓĻņClµÄĘ«ŅĘ³Ģ¶Č±ČHClOµÄ“ó£¬HClO4øüŅ×µēĄė³öH+£¬ĖįŠŌŌ½Ē棻
¢ŚŅŌ¶„µćNi2+ĪŖ²ĪÕÕ£¬ĘäÖÜĪ§µČ¾ąĒŅ×ī½üµÄŃõĄė×Ó“¦ÓŚĄāŠÄ£¬æÉÖŖNi2+µÄÅäĪ»ŹżĪŖ3”Į8”Į![]() £½6£®Čō¾§°ūÖŠNi2+¾ąĄė×ī½üµÄO2©Ö®¼äµÄ¾ąĄėĪŖa pm£¬Ōņ¾§°ū²ĪŹżĪŖ2a pm£½2a”Į10©10cm£¬¾§°ūĢå»żV£½(2a”Į10©10)3cm3£®¾§°ūÖŠNi2+ŹżÄæĪŖ8”Į
£½6£®Čō¾§°ūÖŠNi2+¾ąĄė×ī½üµÄO2©Ö®¼äµÄ¾ąĄėĪŖa pm£¬Ōņ¾§°ū²ĪŹżĪŖ2a pm£½2a”Į10©10cm£¬¾§°ūĢå»żV£½(2a”Į10©10)3cm3£®¾§°ūÖŠNi2+ŹżÄæĪŖ8”Į![]() +4”Į
+4”Į![]() £½4£¬O2©ŹżÄæĪŖ12”Į
£½4£¬O2©ŹżÄæĪŖ12”Į![]() +1£½4£¬Ōņ¾§°ūµÄÖŹĮæm£½
+1£½4£¬Ōņ¾§°ūµÄÖŹĮæm£½![]() £¬¹Ź¾§°ūĆÜ¶Č¦Ń£½
£¬¹Ź¾§°ūĆÜ¶Č¦Ń£½![]() £½
£½![]() gcm©3”£
gcm©3”£


 ½ņĒŽĢÓż¼ĘĖ抔דŌŖĻµĮŠ“š°ø
½ņĒŽĢÓż¼ĘĖ抔דŌŖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·Ö×ÓŹ½ĪŖC4H8O3µÄÓŠ»śĪļÄÜÓėNaHCO3ČÜŅŗ·“Ó¦£»0.1 moløĆÓŠ»śĪļÓė×ćĮ潚ŹōÄĘ·“Ó¦Ź±æÉŅŌŹÕ¼Æµ½±źæöĻĀµÄĘųĢå2.24 L”£Ōņ·ūŗĻÉĻŹöĢõ¼žµÄÓŠ»śĪļÓŠ(²»æ¼ĀĒĮ¢ĢåŅģ¹¹)
A.2ÖÖB.3ÖÖC.4ÖÖD.5ÖÖ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĶÖ¬ŹĒÖŲŅŖµÄÓŖŃųĪļÖŹ£®Ä³ĢģČ»ÓĶÖ¬AæÉ·¢ÉśĻĀĮŠ·“Ó¦£ŗ
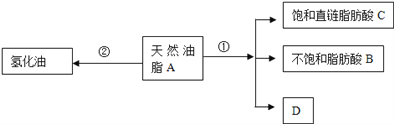
ŅŃÖŖ£ŗAµÄ·Ö×ÓŹ½ĪŖC57H106O6£®1moløĆĢģČ»ÓĶÖ¬A¾·“Ó¦¢ŁæɵƵ½1molD”¢1mol²»±„ŗĶÖ¬·¾ĖįBŗĶ2molÖ±Į“±„ŗĶÖ¬·¾ĖįC£®¾²ā¶ØBµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ280£¬Ō×ÓøöŹż±ČĪŖC£ŗH£ŗO=9£ŗ16£ŗ1£»
£Ø1£©Š“³öBµÄ·Ö×ÓŹ½£ŗ________________________£»
£Ø2£©Š“³ö·“Ó¦¢ŁµÄ·“Ó¦ĄąŠĶ£ŗ____________£»CµÄĆū³Ę(»ņĖ׳Ę)ŹĒ_________£»
£Ø3£©½üČÕ£¬µēŹÓĆ½Ģå¹ŲÓŚ”°Ēā»ÆÓĶĪ£ŗ¦æ°±Čɱ³ę¼Į”±µÄ±ØµĄŅż·¢ŠłČ»“ó²Ø£¬·“Ó¦¢ŚĪŖĢģČ»ÓĶÖ¬µÄĒā»Æ¹ż³Ģ£®ĻĀĮŠÓŠ¹ŲĖµ·Ø²»ÕżČ·µÄŹĒ_______________£»
a£®Ēā»ÆÓĶÓÖ³ĘČĖŌģÄĢÓĶ£¬Ķس£ÓÖ½ŠÓ²»ÆÓĶ£®
b£®Ö²ĪļÓĶ¾¹żĒā»Æ“¦Ąķŗó»į²śÉśø±²śĘ··“Ź½Ö¬·¾ĖįøŹÓĶõ„£¬ÉćČė¹ż¶ąµÄĒā»ÆÓĶ£¬ČŻŅ׶ĀČūŃŖ¹Ü¶ųµ¼ÖĀŠÄÄŌŃŖ¹Ü¼²²”£®
c£®Ēā»ÆÓĶµÄÖʱøŌĄķŹĒŌŚ¼ÓČČÖ²ĪļÓĶŹ±£¬¼ÓČė½šŹō“߻ƼĮ£¬ĶØČėĒāĘų£¬Ź¹ŅŗĢ¬ÓĶÖ¬±äĪŖ°ė¹ĢĢ¬»ņ¹ĢĢ¬ÓĶÖ¬£®
d£®ÓĶÖ¬µÄĒā»ÆÓėÓĶÖ¬µÄŌķ»Æ¶¼ŹōÓŚ¼Ó³É·“Ó¦
£Ø4£©DŗĶ×ćĮ潚ŹōÄĘ·“Ó¦µÄ»Æѧ·½³ĢŹ½_____________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ²ŻĖįŃĒĢś¾§Ģå£ØFeC2O4-2H2O£¬M=180g.mol-1£©ĪŖµ»ĘÉ«¹ĢĢ壬ÄŃČÜÓŚĖ®£¬æÉÓĆ×÷µē³ŲÕż¼«²ÄĮĻĮ×ĖįĢśļ®µÄŌĮĻ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
ŹµŃé1Ģ½¾æ“æ²ŻĖįŃĒĢś¾§ĢåČČ·Ö½ā²śĪļ
£Ø1£©ĘųĢå²śĪļ³É·ÖµÄĢ½¾æ£¬Éč¼ĘČēĻĀ×°ÖĆ£ØæÉÖŲø“Ń”ÓĆ£©½ųŠŠŹµŃé£ŗ
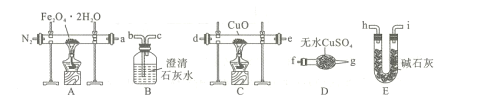
¢Ł×°ÖĆBµÄĆū³ĘĪŖ ____”£
¢Ś°“ÕÕĘųĮ÷“Ó×óµ½ÓŅµÄ·½Ļņ£¬ÉĻŹö×°ÖƵÄĮ¬½ÓĖ³ŠņĪŖa”ś___ ”śµćČ¼£ØĢīŅĒĘ÷½ÓæŚµÄ×ÖÄø±ąŗÅ£©”£
¢ŪĪŖĮĖÅž”×°ÖĆÖŠµÄæÕĘų£¬·ĄÖ¹¼ÓČČŹ±·¢Éś±¬ÕØ£¬ŹµŃéĒ°Ó¦½ųŠŠµÄ²Ł×÷ŹĒ____”£
¢ÜC“¦¹ĢĢåÓÉŗŚ±äŗģ£¬ĘäŗóµÄ³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē£¬ŌņÖ¤Ć÷ĘųĢå²śĪļÖŠŗ¬ÓŠ____”£
£Ø2£©¹ĢĢå²śĪļ³É·ÖµÄĢ½¾æ£¬“ż¹ĢĢåČČ·Ö½ā³ä·Öŗó£¬A“¦²ŠĮōŗŚÉ«¹ĢĢ唣ŗŚÉ«¹ĢĢåæÉÄÜŹĒFe»ņFeO£¬Éč¼ĘŹµŃéÖ¤Ć÷Ęä³É·ÖĪŖFeOµÄ²Ł×÷¼°ĻÖĻóĪŖ____”£
£Ø3£©ŅĄ¾Ż£Ø1£©ŗĶ£Ø2£©½įĀŪ£¬A“¦·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ____”£
ŹµŃé2²ŻĖįŃĒĢś¾§Ģåѳʷ“æ¶ČµÄ²ā¶Ø
¹¤ŅµÖĘµĆµÄ²ŻĖįŃĒĢś¾§ĢåÖŠ³£ŗ¬ÓŠFeSO4ŌÓÖŹ£¬²ā¶ØĘä“æ¶ČµÄĮ÷³ĢČēĻĀĶ¼£ŗ

£Ø4£©²ŻĖįŃĒĢś¾§ĢåČܽāĖį»ÆÓĆKMnO4ČÜŅŗµĪ¶ØÖĮÖÕµćµÄĄė×Ó·½³ĢŹ½ĪŖ____”£
£Ø5£©²ŻĖįŃĒĢś¾§ĢåѳʷµÄ“æ¶ČĪŖ ____£ØÓĆ“śŹżŹ½±ķŹ¾£©£¬ČōÅäÖĘČÜŅŗŹ±Fe2+±»Ńõ»Æ£¬Ōņ²ā¶Ø½į¹ū½«____£ØĢī”°Ę«øß”±”°Ę«µĶ”±»ņ”°²»±ä”±£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æW”¢P”¢Q”¢MŹĒŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄ¶ĢÖÜĘŚŌŖĖŲ£¬a”¢b”¢c”¢d·Ö±šŹĒÕā4ÖÖŌŖĖŲµÄµ„ÖŹ£¬¼×”¢ŅŅ”¢±ū”¢¶”·Ö±šŹĒÓÉÕāŠ©ŌŖĖŲ×é³ÉµÄ»ÆŗĻĪļ”£ŅŃÖŖ£ŗQŹĒµŲæĒÖŠŗ¬Įæ×īøߵĽšŹōŌŖĖŲ£»Ļņ¼×µÄČÜŅŗÖŠĶØČė±ūĘųĢ壬²śÉś°×É«³Įµķ£»±ūĘųĢåČÜÓŚĖ®£¬ČÜŅŗ³Ź¼īŠŌ”£ĖüĆĒÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
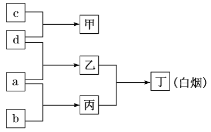
A.ŌŖĖŲ·Ē½šŹōŠŌ£ŗM£¾W£¾P
B.¶”ŹĒŗ¬ÓŠ¹²¼Ū¼üµÄĄė×Ó»ÆŗĻĪļ
C.PµÄŃõ»ÆĪļµÄĖ®»ÆĪļŅ»¶ØŹĒĒæĖį
D.¼×”¢ŅŅ”¢±ū”¢¶”ĖÄÖÖ»ÆŗĻĪļ¾łÄÜŅÖÖĘĖ®µÄµēĄė
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”涞ĀČ»Æ¶žĮņ(S2Cl2)ŹĒ¹ć·ŗÓĆÓŚĻš½ŗ¹¤ŅµµÄĮņ»Æ¼Į£¬Ęä·Ö×Ó½į¹¹ČēÓŅĻĀĶ¼ĖłŹ¾”£³£ĪĀĻĀ£¬S2Cl2ŹĒŅ»ÖÖ³Č»ĘÉ«µÄŅŗĢ壬ÓöĖ®¾ēĮŅ·“Ó¦£¬²¢²śÉśÄÜŹ¹Ę·ŗģĶŹÉ«µÄĘųĢ唣ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ

A. S2Cl2µÄ·Ö×ÓÖŠµÄĮ½øöSŌ×Ó¾łŹĒsp3ŌÓ»Æ
B. S2Br2ÓėS2Cl2½į¹¹ĻąĖĘ£¬ČŪ·Šµć£ŗS2Br2 > S2Cl2
C. S2Cl2ÓėH2O·“Ó¦µÄ»Æѧ·½³ĢŹ½æÉÄÜĪŖ£ŗ2S2Cl2+2H2O = SO2”ü+3S”ż+4HCl
D. S2Cl2·Ö×ÓÖŠµÄSĪŖ+1¼Ū£¬ŹĒŗ¬ÓŠ¼«ŠŌ¼üŗĶ·Ē¼«ŠŌ¼üµÄ·Ē¼«ŠŌ·Ö×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æX”¢Y”¢Z”¢WĪŖŌŖĖŲÖÜĘŚ±ķĒ°ĖÄÖÜĘŚµÄŌŖĖŲ”£ĘäÖŠXĪŖŠĪ³ÉµÄ»ÆŗĻĪļÖŠÖÖĄą×ī¶ąµÄŌŖĖŲ£¬YµÄÄŚ²ćµē×ÓŹżŹĒ×īĶā²ćµē×ÓŹżµÄ9±¶£¬ZŌŚŌŖĖŲÖÜĘŚ±ķµÄø÷ŌŖĖŲÖŠµēøŗŠŌ×ī“ó£¬WŌŖĖŲµÄµŚČżµē×Ó²ć“¦ÓŚČ«³äĀś×“Ģ¬ĒŅµŚĖĵē×Ó²ćÖ»ÓŠ2øöµē×Ó”£Ēė»Ų“šĻĀĮŠĪŹĢā£®

£Ø1£©WŌŖĖŲŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆĪŖ____________________________”£
£Ø2£©±Č½ĻXZ4ŗĶYZ2µÄČŪ·Šµć“󊔲¢ĖµĆ÷ĄķÓÉ________________________”£
£Ø3£©W2+ÄÜÓė°±Ęų·Ö×ÓŠĪ³ÉÅäĄė×Ó[W(NH3)4]2+”£Š“³öøĆÅäĄė×ӵĽį¹¹¼ņŹ½(±źĆ÷ÅäĪ»¼ü)__”£
£Ø4£©XÄÜÓėĒā”¢µŖ£¬ŃõČżÖÖŌŖĖŲ¹¹³É»ÆŗĻĪļXO(NH2)2£¬ĘäÖŠXŌ×ÓµÄŌӻƷ½Ź½ĪŖ__£¬1mol·Ö×ÓÖŠ¦Ņ¼üµÄŹżÄæĪŖ__£¬øĆĪļÖŹŅ×ČÜĖ®µÄÖ÷ŅŖŌŅņŹĒ_______________________”£
£Ø5£©XµÄijÖÖ¾§ĢåĪŖ²ćד½į¹¹£¬æÉÓėČŪČŚ½šŹō¼Ų×÷ÓĆ”¢¼ŲŌ×ÓĢī³äŌŚø÷²ćÖ®¼ä£¬ŠĪ³É¼äĻ¶»ÆŗĻĪļ£¬Ęä³£¼ū½į¹¹µÄĘ½ĆęĶ¶Ó°ČēĶ¼¢ŁĖłŹ¾£¬ŌņĘä»ÆѧŹ½Ź±±ķŹ¾ĪŖ_________”£
£Ø6£©ŌŖĖŲYÓėŌŖĖŲZŠĪ³ÉµÄ¾§Ģå½į¹¹ČēĶ¼¢ŚĖłŹ¾£¬¾§°ūÖŠYĄė×ÓµÄÅäĪ»ŹżĪŖ_______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ŌĆŗøÉĮó²¢¼ģŃéĘäÖŠ²æ·Ö²śĪļ£¬×°ÖĆ(¼Š³Ö×°ÖĆŅŃĀŌ)ČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
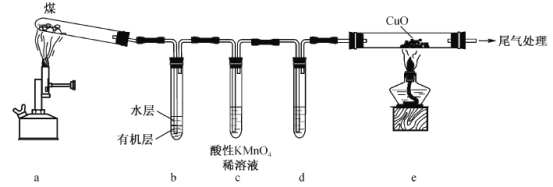
A.ĆŗµÄøÉĮó¹ż³Ģ·¢Éśø“ŌÓµÄĪļĄķ”¢»Æѧ±ä»Æ
B.Ļņb×°ÖƵÄĖ®²ćÖŠµĪČė×ĻÉ«ŹÆČļČÜŅŗ£¬ČÜŅŗ±äĄ¶
C.c×°ÖĆæɼģŃé²śÉśµÄĘųĢåÖŠŅ»¶Øŗ¬ÓŠH2S
D.e×°ÖĆÖŠ²śÉśµÄĻÖĻóŹĒ¹ĢĢåÓÉŗŚÉ«±äĪŖŗģÉ«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æH2CO3 ŗĶ H2C2O4 ¶¼ŹĒ¶žŌŖČõĖį£¬²»Ķ¬ pH »·¾³ĻĀĖüĆĒ²»Ķ¬ŠĪĢ¬µÄĮ£×ÓµÄ×é³É°Ł·ÖĀŹČēĶ¼ĖłŹ¾£ŗ

ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ŌŚ pH ĪŖ 6.37 ¼° 10.25 Ź±£¬ČÜŅŗÖŠ c(H2CO3)£½c(HCO3£)£½c(CO32£)
B. ·“Ó¦ HCO3££«H2O![]() H2CO3£«OH£µÄĘ½ŗā³£ŹżĪŖ 10£7.63
H2CO3£«OH£µÄĘ½ŗā³£ŹżĪŖ 10£7.63
C. 0.1 molL£1 NaHC2O4 ČÜŅŗÖŠ c(HC2O4£)£«2c(C2O42£)£«c(H2C2O4) £½0.1 molL£1
D. Ķł Na2CO3 ČÜŅŗÖŠ¼ÓČėÉŁĮæ²ŻĖįČÜŅŗ£¬·¢Éś·“Ó¦£ŗCO32££«H2C2O4£½HCO3££«HC2O4-
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com