


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、C2H2 |
| B、C2H6 |
| C、C3H6 |
| D、C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol N2、3mol H2 | 4mol NH3 |
| NH3的浓度(mol?L-1) | c1 | c2 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ |
| 气体密度 | ρ1 | ρ2 |
| 反应物转化率 | α1 | α2 |
| A、①③ | B、①④ | C、②③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[Abc]5g18s2 |
| B、[Abc]8s28p1 |
| C、[Abc]7d18s2 |
| D、[Abc]6f18s2 |
| E、[Abc]6f18s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
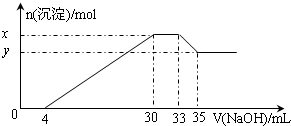 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A、原溶液中n(Mg2+):n(Al3+)=5:2 |
| B、原溶液的c(H+)=0.01 mol/L |
| C、x与y的差值为0.01 mol |
| D、原溶液中c(Cl-)=0.75mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com