
分析 (1)钠燃烧生成过氧化钠,过氧化钠与二氧化碳反应生成氧气和碳酸钠;
(2)分析反应中元素化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
解答 解:(1)钠燃烧生成过氧化钠,方程式:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,过氧化钠与二氧化碳反应生成氧气和碳酸钠,方程式:2Na2O2+2CO2=2Na2CO3+O2;
故答案为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;2Na2O2+2CO2=2Na2CO3+O2;
(2)反应中铁元素从+2价升高为+3价,高锰酸根离子中锰元素从+7价降为+2价,要使得失电子守恒,则二价铁离子系数为5,高锰酸根离子系数为1,依据原子个数守恒反应的方程式:5Fe2++1MnO4-+8H+=5Fe3++1Mn2++4H2O;
故答案为:5;1;8H+;5;1;4;
点评 本题考查了化学方程式的书写,氧化还原反应方程式配平,明确钠及过氧化钠的性质及氧化还原反应得失电子守恒、原子个数守恒规律即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 海水蒸发制海盐的过程是化学变化 | |
| B. | 海洋中有丰富的潮汐能、波浪能等新型能源 | |
| C. | 海水中提取溴单质的过程涉及氧化还原反应 | |
| D. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析发等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
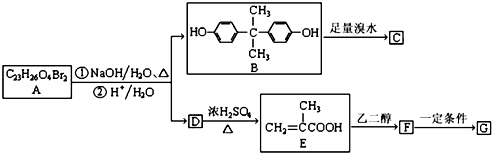
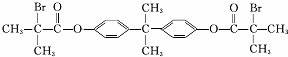
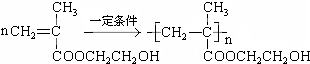 .
.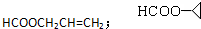 .
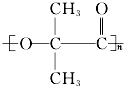
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
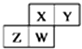 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值可能相等 | |
| D. | Z的最高价氧化物的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| B. | 钢铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| C. | 绿色化学的核心是从源头上消除工业生产对环境的污染 | |
| D. | 汽油、柴油和植物油都是碳氢化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25°C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA | |
| B. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| C. | 含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA | |
| D. | 2mL 0.5mol/L硅酸钠溶液中滴入过量盐酸制备硅酸胶体,所得胶粒数目为0.001NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
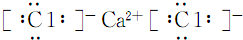 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com