
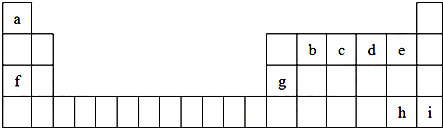
分析 由元素在周期表中位置可知,a为H、b为C、c为N、d为O、e为F、f为Na、g为Al、h为Br,i为Kr.
(1)f的最高价氧化物对应的水化物为氢氧化钠;
(2)同周期从左向右原子半径减小;
(3)非金属性越强,对应氢化物越稳定;
(4)a、f、g元素对应的氧化物中,只有氧化铝为两性氧化物,与酸、碱均反应生成盐和水.
解答 解:由元素在周期表中位置可知,a为H、b为C、c为N、d为O、e为F、f为Na、g为Al、h为Br,i为Kr.
(1)f的最高价氧化物对应的水化物为氢氧化钠,化学式为NaOH,故答案为:NaOH;
(2)同周期从左向右原子半径减小,则b、c、d、e的原子半径依次减小,故答案为:减小;
(3)非金属性越强,对应氢化物越稳定,则HF更稳定,故答案为:HF;
(4)a、f、g元素对应的氧化物中,只有氧化铝为两性氧化物,氧化铝的化学式为Al2O3,故答案为:Al2O3.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | F-的结构示意图: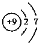 | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | 氮气的电子式: | |
| D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为置换反应 | B. | 该晶体为分子晶体 | ||
| C. | 该物质是一种新的化合物 | D. | 该物质的相对分子质量是2400 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有④⑤ | C. | 只有①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | C | |
| B |
| A. | 最高价氧化物对应水化物的酸性:C>B | |
| B. | C单质是氧化性最强的非金属单质 | |
| C. | A的氢化物中不可能含有非极性共价键 | |
| D. | B位于第三周期ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 21:5 | B. | 11:3 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:从反应开始到10s,X的物质的量减少了0.8 mol,Z的物质的量浓度增大了0.8 mol/L,用Z表示的反应速率为0.08 mol/(L•s).
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:从反应开始到10s,X的物质的量减少了0.8 mol,Z的物质的量浓度增大了0.8 mol/L,用Z表示的反应速率为0.08 mol/(L•s).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热氢氧化钠晶体使之熔化 | B. | 电解水使之分解 | ||
| C. | 碘单质受热升华 | D. | 加热二氧化硅晶体使之熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g 甲烷中含有的原子数为NA | |
| B. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA | |
| C. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| D. | 14 g乙烯和丙烯(它是乙烯的同系物,相对分子质量相差14)混合气体中的氢原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com