
【题目】胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(![]() )等化合物。
)等化合物。
(1)铝单质与同周期中非金属性最强的元素的气态氢化物的水溶液之间发生反应的离子方程式为:____________
(2)某元素与铝元素同周期且原子半径比镁原子半径大,写出该元素符号______,该元素的最高价氧化物的水化物与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:______________
(3)![]() 、MgO和
、MgO和![]() 都可以制耐火材料,其原因是______
都可以制耐火材料,其原因是______
a. ![]() 、MgO和
、MgO和![]() 都是白色固体
都是白色固体
b. ![]() 、MgO和
、MgO和![]() 都是氧化物
都是氧化物
c. ![]() 、MgO和
、MgO和![]() 都有很高的熔点
都有很高的熔点
(4)氢氧化铝在强酸溶液中的电离方程式________。
(5)明矾常用作净水剂,结合相关理论解释其净水原理__________。
(6)用于治疗胃酸过多的药物还有多种,请写出其中一种的化学式_____________。
【答案】2Al+6H+=2Al3++3H2↑ Na Al(OH)3+OH-=AlO2-+2H2O c Al(OH)3![]() Al3++3OH- 明矾溶于水发生Al3++3H2O
Al3++3OH- 明矾溶于水发生Al3++3H2O![]() Al(OH)3+3H+,生成Al(OH)3能吸附水中的悬浮物质 NaHCO3
Al(OH)3+3H+,生成Al(OH)3能吸附水中的悬浮物质 NaHCO3
【解析】
(1)与铝同周期非金属性最强的元素是氯元素,由题意写出离子方程式;
(2)根据半径的变化规律来确定元素,利用物质之间的反应来写出反应的离子方程式;
(3)根据耐火材料的特点来选择.
(1)与铝同周期非金属性最强的元素是氯元素,其气态氢化物是氯化氢,反应的离子方程式是2Al+6H+=2Al3++3H2↑,
故答案为:2Al+6H+=2Al3++3H2↑;
(2)与铝元素同周期且原子半径比镁原子半径大的元素是钠元素,其符号是:Na,该元素的最高价氧化物的水化物是氢氧化钠,与氢氧化铝反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Na;Al(OH)3+OH-=AlO2-+2H2O;
(3)所谓耐火材料,就是要耐得住高温,所以显然要有很高的熔点,c对;
故答案为:c。
(4)氢氧化铝在强酸环境中应该发生碱式电离,电离方程式是:Al(OH)3![]() Al3++3OH-,
Al3++3OH-,
故答案为:Al(OH)3![]() Al3++3OH-;
Al3++3OH-;
(5)明矾溶于水电离出铝离子,铝离子水解生成氢氧化铝胶体,吸附水中的悬浮物,达到净水的目的,
故答案为:明矾溶于水发生Al3++3H2O![]() Al(OH)3+3H+,生成Al(OH)3能吸附水中的悬浮物质 ;
Al(OH)3+3H+,生成Al(OH)3能吸附水中的悬浮物质 ;
(6)用于治疗胃酸过多的药物还有多种,除了氢氧化铝外还有碳酸氢钠,
故答案为:NaHCO3 。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上由煤炭出发制取有机化工原料乙炔,流程如下。回答以下问题:
![]()
(1)由煤炭得到焦炭的工业操作为_____________。
a.分馏 b.干馏 c.裂化 d.裂解
(2)实验室用电石(CaC2)来制备乙炔,反应的化学方程式为:___________。乙炔是一种稍有气味的气体,但实验室制备的乙炔气体具有令人厌恶的刺激性气味,可用某种溶液进行检验,写出检验此气体的化学方程式:___________
(3)乙炔能使溴水褪色,说明乙炔发生_____________反应(反应类型);乙炔能使酸性高锰酸钾褪色,说明乙炔容易被_____________。导电高分子是以聚乙炔为载体的高聚物,写出反应Ⅱ的化学方程式:_____________。
(4)乙炔在一定条件下,三聚得到CH2﹦CH—C≡C—CH﹦CH2:,写出该三聚物具有相同化学式且不易发生加成反应物质的结构简式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计如图所示装置制取较多量乙酸乙酯。已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
下列说法正确的是
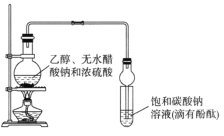
A.装置中球形管既能冷凝蒸气又能防止倒吸
B.反应结束后大试管中的现象是:溶液分层,下层无色油状液体;上层溶液颜色变浅
C.从大试管中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出乙醇
D.最后加入无水硫酸钠,然后进行蒸馏,收集118℃左右的馏分,以得到较纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的价电子排布式为______________________。
(2)A的最高价氧化物分子中,其中心原子采取________杂化;BC3-的立体构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)化合物CH3COO[Cu(NH3)3·CO]中与Cu+形成配离子的配体为____________(填化学式)。
(5) CH3COOH中C原子杂化轨道类型为_________________。

(6)元素D与元素C形成一种化合物其晶胞结构如图所示,该化合物的化学式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
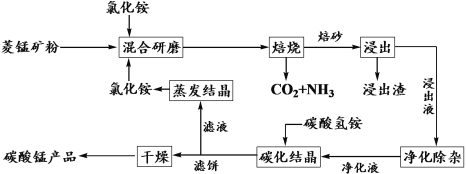
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②相关金属离子[c(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“焙烧”时主要反应的化学方程式为__________________。
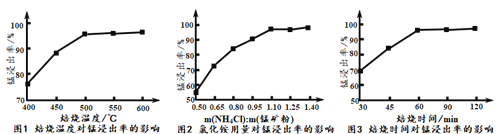
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:_________________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________________________;然后调节溶液pH使Fe3+、Al3+沉淀完全。
(4)碳化结晶时,发生反应的离子方程式为___________,碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是___________________。
(5)流程中能循环利用的固态物质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空:
N | O | F | |||||
Mg | Al | S | Cl | ||||
(1)N元素形成的单质的电子式_________;N元素的气态氢化物含有化学键属于_______(“离子键”或“共价键”)。
(2)Mg和Al中,金属性较强的是_______(写元素符号),写出一条能说明该结论的事实(用文字描述)___________
(3)S和Cl中,非金属性较强的是___________(写元素符号),不能说明该结论的事实是________(填字母符号)。
a. 单质硫难溶于水,氯气能溶于水
b. ![]() 通入
通入![]() 溶液中,溶液变浑浊
溶液中,溶液变浑浊
c. 受热时![]() 易分解,HCl不易分解
易分解,HCl不易分解
d. 氯气与铁反应生成![]() ,硫与铁反应生成FeS
,硫与铁反应生成FeS
(4)O和S中,非金属性较强的是_________(写元素符号),写出能说明该结论的化学方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在HA和NaA的混合溶液中 c(HA)+c(A-)=0.1 mol·L-1,溶液中c(HA) 和c(A-)的大小随着pH变化的关系如图所示。下列有关叙述不正确的是
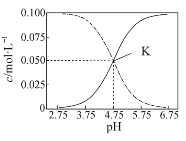
A.常温下,HA的电离平衡常数约为10-5
B.在pH=3.75溶液中:c(Na+)+c(H+)+c(HA) = c(OH-) +0.1 mol·L-1
C.在pH=5.75溶液中:c(OH-)<c(H+)<c(A-)<c(HA)
D.在K点的溶液中,HA的电离程度大于A-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,其原理如图所示。下列有关说法错误的是( )
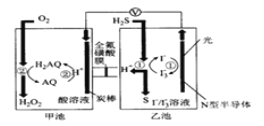
A.图中导线上标记方向为电子流向
B.装置中H+向甲池迁移
C.正极上的电极反应式为O2+4H++4e-=2H2O
D.乙池溶液中发生反应的离子方程式:H2S+I3- =3I-+S↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取相同质量的H2O和D2O分别与少量金属钾反应完全,若电子转移数目相同,则下列叙述中有关物理量不相等的是( )
A.反应消耗H2O和D2O的物质的量B.产生气体在相同条件下的体积
C.反应后所得溶液溶质的质量分数D.参加反应金属钾的质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com