
【题目】(NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(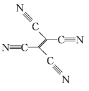 )。
)。
①CH3CN中碳原子的杂化方式是 ____ 和_____ 。
②TCNE中第一电离能较大的是 ___(填元素符号),分子中所有原子____(填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:
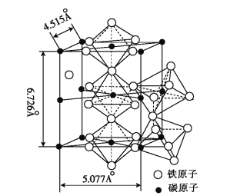
Fe3C的密度为 ___(列出计算式)g·cm-3。
【答案】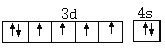 Fe的原子半径比Ca小,价电子数更多,金属键更强 N>S>H sp3 sp N 在 1:1
Fe的原子半径比Ca小,价电子数更多,金属键更强 N>S>H sp3 sp N 在 1:1 ![]()
【解析】
(1)Fe元素的原子序数为26,由电子排布规律书写价层电子的电子排布图;
(2)金属单质中金属原子的原子半径越大,价电子越少,金属键越弱,熔沸点越低;
(3)元素的非金属性越强,电负性越大;
(4)①—CH3中饱和碳原子的杂化方式是sp3杂化,—C≡N中饱和碳原子的杂化方式是sp杂化;
②TCNE分子是由4个氰基和1个碳碳双键构成,同一周期元素的第一电离能随着原子序数的增大而增大;氰基中碳原子和氮原子在同一直线上,碳碳双键上的碳原子和连接的原子在同一平面;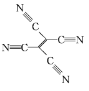 分子中含有9个σ 键和9个π键;
分子中含有9个σ 键和9个π键;
(5)由均摊法计算可得。
(1)Fe元素的原子序数为26,基态Fe原子价层电子的电子排布图(轨道表达式)为 ,故答案为:
,故答案为: ;
;
(2)Fe的价电子排布式为3d64s2,Ca的价电子排布式为4s2,Fe与Ca位于同一周期,Ca的原子半径较大,且价电子较少,金属键较弱,则金属Ca的熔点、沸点等都比金属Fe低,故答案为:Fe的原子半径比Ca小,价电子数更多,金属键更强;
(3)元素的非金属性越强,电负性越大,非金属性N>S>H,则电负性N>S>H,故答案为:N>S>H;
(4)①CH3CN分子中含有—CH3和—C≡N,—CH3中饱和碳原子的杂化方式是sp3杂化,—C≡N中饱和碳原子的杂化方式是sp杂化,故答案为:sp3;sp
②TCNE分子是由4个氰基和1个碳碳双键构成,C、N属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大而增大,则第一电离能大小顺序是N>C;氰基中碳原子和氮原子在同一直线上,碳碳双键上的碳原子和连接的原子在同一平面,则TCNE分子中所有原子在同一平面; 分子中含有9个σ 键和9个π键,σ 键与π键的数目之比为1:1,故答案为:N;在;1:1;
分子中含有9个σ 键和9个π键,σ 键与π键的数目之比为1:1,故答案为:N;在;1:1;
(5)由晶胞结构可知,每个碳原子周围有6个铁原子,构成正八面体,正八面体的化学式为Fe3C,体内碳原子形成1个正八面体、面心碳原子形成![]() 个正八面体、顶点和棱上碳原子形成
个正八面体、顶点和棱上碳原子形成![]() 个正八面体,则1个晶胞结构中含有4个Fe3C,由质量公式可得
个正八面体,则1个晶胞结构中含有4个Fe3C,由质量公式可得![]() =(4.515×10—8×5.077×10—8)×6.726×10—8d,解得密度d=
=(4.515×10—8×5.077×10—8)×6.726×10—8d,解得密度d=![]() g·cm-3,故答案为:
g·cm-3,故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】乙酸和甲酸甲酯互为同分异构体,其结构式分别如下
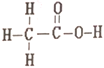 和
和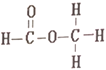
在下列哪种检测仪上显示出的信号是完全相同的
A. 李比希元素分析仪 B. 红外光谱仪
C. 核磁共振仪 D. 质谱仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
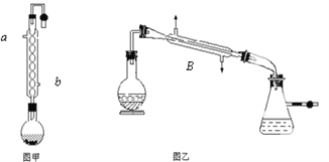
请回答下列问题
(1)图甲中冷凝水从______(a或b)进,图乙中B装置的名称为_______;
(2)图甲在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入沸石,目的是_______;
(3)反应中加入过量的乙醇,目的是_______;
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
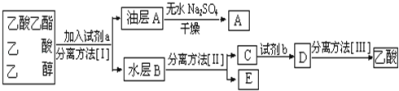
则试剂a是______,分离方法I是_______,分离方法II是_______,产物E是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯的结构简式为______________________________
(2)![]() 名称为_______________________________________
名称为_______________________________________
(3)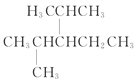 名称为:________________________________
名称为:________________________________
(4)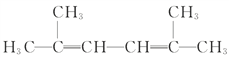 名称为:_______________
名称为:_______________
(5)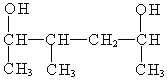 名称为:___________________________
名称为:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1 mol/LNaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数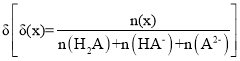 如图所示:
如图所示:
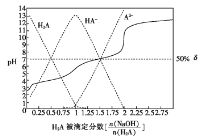
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1NaA溶液中: ![]()
C.0.1 mol·L-1NaHA溶液中: ![]()
D.H2A 的K2=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.常温常压下,18g甲烷(14CH4)所含的中子数为9NA
B.25℃时,pH=7的纯水中含OH-的数目为10-7NA
C.铜与浓硝酸反应生成NO2、N2O4共23g,则铜失去的电子数为0.5NA
D.密闭容器中2mol NO与1mol O2充分反应,所得产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,常温下CH3COOH和NH3·H2O的电离常数均为1.8×10-5。某小组进行如图三组实验且实验II、III中Mg(OH)2固体均溶解。下列说法正确的是
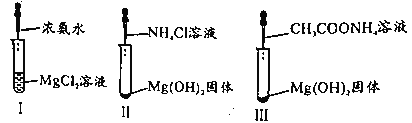
A.I中现象说明NH3·H2O碱性强于Mg(OH)2
B.II中总反应为2H++Mg(OH)2=Mg2++2H2O
C.实验II、III研究NH4+对Mg(OH)2溶解的作用原理
D.III中CH3COONH4浓度越小,越有利于沉淀的溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于![]() 的叙述错误的是( )
的叙述错误的是( )
A.是两性氢氧化物
B.是难溶于水的白色胶状物质,是弱电解质
C.既溶于氨水,又能溶于醋酸
D.能凝聚水中悬浮物,可用做净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )

A. 当有0.8mol电子转移时,b极产生4.48LO2
B. 为了增加导电性可以将左边容器中的水改为NaOH溶液
C. d极上发生的电极反应是:2H+ +2e-=H2
D. c极上进行氧化反应,A池中的H+可以通过隔膜进入B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com