
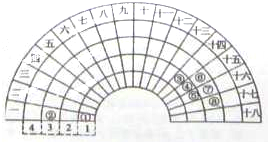
 元素周期的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( )
元素周期的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( )| A、③元素形成的单质晶体均属于原子晶体 |
| B、④元素的气态氢化物易液化,是因为其分子间存在氢键 |
| C、②、⑦、⑧对应的简单离子半径依次减小 |
| D、实验室可根据⑥、⑦单质分别与⑤单质反应的难易程度来比较元素的非金属性强弱 |


科目:高中化学 来源: 题型:
| A、燃烧化石燃料排放的废气中含有大量SO2,易形成酸雨 |
| B、为防止垃圾污染城市,可采用露天焚烧或深埋的方法进行处理 |
| C、含氮、磷化合物的生物污水大量排放会使水体富营养化 |
| D、PM2.5指大气中直径小于或等于2.5微米的颗粒物,它对空气质量和能见度等有重要的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解MgCl2饱和溶液制取金属镁 |
| B、SO2具有还原性,可使酸性KMn04溶液退色 |
| C、双氧水被称为绿色氧化剂,是因为其还原产物为O2 |
| D、新制备的氯水中存在三种分子、四种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,请回答下列问题:
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 A、D、E、X、Y是原子序数依次增大的短周期主族元素.其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用.
A、D、E、X、Y是原子序数依次增大的短周期主族元素.其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨工业常采用合适的催化剂 |
| B、配制FeCl2溶液时在溶液中加入少量铁粉 |
| C、NO2与N2O4的平衡体系加压,气体颜色会变深 |
| D、向重铬酸钾溶液中滴加几滴氢氧化钠溶液后,溶液由橙色变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL0.1mol/L的NaCl溶液中,所含微粒总数为0.02NA |
| B、在标准状况下,11.2LSO3所含分子数为0.5NA |
| C、1molNa与足量O2反应生成Na2O或Na2O2均失去NA电子 |
| D、两份质量为5.6g的铁分别与足量的盐酸、氯气反应,电子转移总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道上电子全充满或半充满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
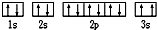 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com