解:(1)变质的过碳酸钠中含有碳酸钠,加入酸能生成CO
2、O
2,反应的方程式分别为Na
2CO
4+H
2SO
4=Na
2SO
4+H
2O
2+CO
2↑,2H
2O
2→2H
2O+O
2↑,Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑,
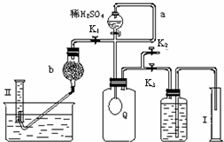
为使分液漏斗内液体顺利流下,应是分液漏斗内外压强相等,
故答案为:CO
2、O
2;平衡分液漏斗上、下的压强,使稀H
2SO
4顺利滴下;
(2)将K
1、K
2、K
3处于关闭状态,然后先打开K
2,再缓缓打开K
1,气体进入左侧容器,气球逐渐变小,量筒Ⅱ目的为测量氧气的体积,氧气中混有二氧化碳,应用碱石灰吸收,
故答案为:气球Q慢慢缩小,左侧导管有气泡生成;吸收二氧化碳;
(3)关闭K1并预先关闭K
2,打开K
3,此时气球膨胀的体积与量筒Ⅰ所接受的水的体积相等,此为CO
2与O
2的体积之和;待气球中反应完全,关闭K
3,打开K
2,再缓缓打开K
1,此时气球渐瘪,气体通过分液漏斗再经干燥管b进入量筒Ⅱ,此时CO
2被干燥管中的吸收剂吸收,量筒Ⅱ中水的体积即为O
2 的体积,
则n(O
2)=
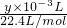
=
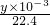
mol,n(O
2)+n(CO
2)=
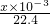
mol,所以n(CO
2)=

mol,
由:2Na
2CO
4~2H
2O
2~O
2,可知n(Na
2CO
4)=
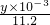
mol,
由:Na
2CO
3~CO
2,可知n(Na
2CO
3)=

mol,
所以:ω(Na
2CO
4)=
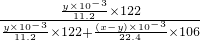
×100%=
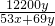
%,
故答案为:
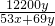
%;
(4)A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ,会导致氧气的体积偏小,过碳酸钠的纯度偏小,故A错误;
B.量筒Ⅱ读数时,量筒液面高于水槽液面,会导致体积偏大,过碳酸钠的纯度偏大,故B正确;
C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x,会导致总体积偏小,氧气的体积偏大,过碳酸钠的纯度偏大,故C正确;
D.气体体积数值x、y没有扣除滴加的硫酸的体积,对测量结果无影响,故D错误.
故答案为:BC.
分析:(1)变质的过碳酸钠中含有碳酸钠,加入酸能生成CO
2、O
2,为使分液漏斗内液体顺利流下,应是分液漏斗内外压强相等;
(2)将K
1、K
2、K
3处于关闭状态,然后先打开K
2,再缓缓打开K
1,气体进入左侧容器,气球逐渐变小,碱石灰能吸收二氧化碳;
(3)关闭K1并预先关闭K
2,打开K
3,此时气球膨胀的体积与量筒Ⅰ所接受的水的体积相等,此为CO
2与O
2的体积之和;待气球中反应完全,关闭K
3,打开K
2,再缓缓打开K
1,此时气球渐瘪,气体通过分液漏斗再经干燥管b进入量筒Ⅱ,此时CO
2被干燥管中的吸收剂吸收,量筒Ⅱ中水的体积即为O
2 的体积,从而可以求出Na
2O
2与Na
2CO
3的物质的量之比,进一步求出
Na
2O
2的纯度;
(4)根据测得的过碳酸钠的纯度超过100%,所测氧气的体积偏大判断.
点评:本题考查混合物含量的测定,题目难度较大,本题易错点为(3)(4),注意量筒Ⅰ、Ⅱ的作用,根据反应的化学方程式计算.

 过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用.
过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用.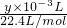 =
=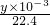 mol,n(O2)+n(CO2)=
mol,n(O2)+n(CO2)=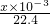 mol,所以n(CO2)=
mol,所以n(CO2)= mol,
mol,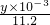 mol,
mol, mol,
mol,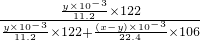 ×100%=
×100%=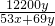 %,
%,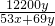 %;
%;

 阅读快车系列答案
阅读快车系列答案