
| A. | 混合气的压强不变 | |
| B. | 混合气的体积不变 | |
| C. | 混合气的密度不变 | |
| D. | 有n个H-H键断裂的同时有2n个H-I键断裂 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、两边的气体计量数相等,所以容器压强始终不变,故A错误;
B、两边的气体计量数相等,在恒温容器中,容器体积始终不变,故B错误;
C、容器体积始终不变,质量始终不变,所以混合气的密度始终不变,故C错误;
D、有n个H-H键断裂等效于2n个H-I键形成,同时有2n个H-I键断裂,正逆反应速率相等,故D正确;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | CaCO3(CaO) | B. | Na2O2(Na2O) | C. | Na2CO3(NaHCO3) | D. | MgO(MgCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Al3+、Cl-、MnO4-、SO42- | |
| B. | 含有大量Fe3+的溶液中:Na+、Mg2+、NO3-、SCN- | |
| C. | 0.1 mol•L-1AgNO3溶液:H+、K+、SO42-、I- | |
| D. | 使酚酞变红色的溶液:CO32-、Cl-、F-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应类型:加聚反应
反应类型:加聚反应 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 密闭容器中发生反应H2+I2=2HI,增大压强时,容器中颜色加深 | |
| C. | 将混合气中的氨气液化后不停的分离出来,有利于合成氨的反应 | |
| D. | 用过量空气煅烧硫铁矿可以提高硫铁矿的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量CO2通入过量氨水中:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 含等物质的量的NH4HSO3与NaOH溶液混合加热:HSO3-+OH-$\frac{\underline{\;△\;}}{\;}$SO32-+H2O | |
| C. | 溴化亚铁溶液中通入少量Cl2:Cl2+2Br-═2Cl-+Br2 | |
| D. | 含1molKOH的溶液与含2molBa(HCO3)2的溶液混合:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
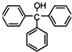 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示. ;
;
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸已酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
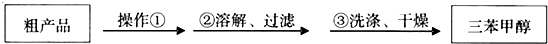
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com