
【题目】二氧化氯(ClO2),黄绿色易溶于水的气体,是高效、低毒的消毒剂。回答下列问题:
(1)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为_____.
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:

①电解时发生反应的化学方程式为_______________________________。
②除去ClO2中的NH3可选用的试剂是________(填标号)。
a.水 b.碱石灰
c.浓硫酸 d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:

Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.100 0 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-===2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为________________。
②测得混合气中ClO2的质量为__________g。
【答案】2:1 NH4Cl+2HCl![]() NCl3+3H2↑ c 2ClO2+10I-+8H+=2Cl-+5I2+4H2O 0.02700
NCl3+3H2↑ c 2ClO2+10I-+8H+=2Cl-+5I2+4H2O 0.02700
【解析】
(1) KClO3在H2SO4存在下与Na2SO3反应制得ClO2,可以知道SO32-被氧化成SO42-,由电子、电荷守恒可以知道该离子反应为2 ClO3-+ SO32-+2H+=2 ClO2+ SO42-+H2O,氧化剂为KClO3,还原剂为Na2SO3,由离子反应可以知道该反应氧化剂与还原剂物质的量之比为2:1;
因此,本题正确答案是: 2:1。
(2)①由生产流程可以知道氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl![]() NCl3+3H2↑;
NCl3+3H2↑;
因此,本题正确答案是: NH4Cl+2HCl![]() NCl3+3H2↑。
NCl3+3H2↑。
②a.ClO2易溶于水,不能利用水吸收氨,故a错误;
b.碱石灰不能吸收氨气,故b错误;
c.浓硫酸可以吸收氨气,且不影响ClO2,故c正确;
d. ClO2易溶于水,不能利用饱和食盐水吸收氨气,故d错误;
因此,本题正确答案是:c。
(3)①由题目信息可以知道, ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O;
因此,本题正确答案是: 2ClO2+10I-+8H+=2Cl-+5I2+4H2O。
④含有Na2SO3物质的量为0.02L×0.1mol/L=0.002mol,则根据关系式:
2 ClO2—5I2—10 S2O32-;
2 10
n(ClO2) 0.002
所以n(ClO2)=0.004mol,m(ClO2)= 0.004mol×67.5g/mol=0.02700g;
因此,本题正确答案是:0.02700。


科目:高中化学 来源: 题型:
【题目】由钠和氧组成的某种离子晶体含钠的质量分数是69/109,其阴离子只有过氧离子(O22-)和氧离子(O2-)两种。在此晶体中,氧离子和过氧离子的物质的量之比为
A. 2∶1 B. 1∶2 C. 1∶1 D. 1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:
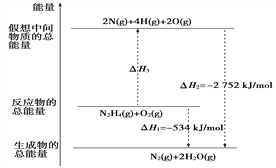
A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存方法正确的是( )
A.浓硝酸保存在无色玻璃瓶中B.少量的白磷保存在冷水中
C.浓硫酸用橡胶塞细口瓶密闭保存D.烧碱溶液保存在玻璃塞试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是
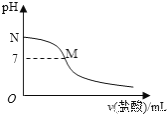
A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
A.NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O ΔH=+Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如下图所示,有关其性质叙述不正确的是

A. 1mol 该化合物最多能与3 mol NaOH 反应 B. 该有机物分子式为C10H8O5
C. 该有机物能发生加成、氧化、取代等反应 D. 分子中有四种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关 HCl 和 HBr 的叙述错误的是( )
A.键能:HCl>HBrB.热稳定性:HBr>HCl
C.沸点:HBr>HClD.共用电子对偏移程度:HCl>HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A. pH=1的NaHSO4溶液: c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 含有AgCl和AgI固体的悬浊液: c(Ag+)>c(Cl-)=c(I-)
C. CO2的水溶液:c(H+)>c(HCO![]() )=2c(CO
)=2c(CO![]() )
)
D. 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com