
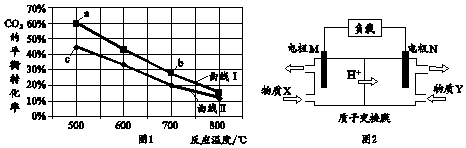
| A. | 图1中b点对应的平衡常数K值大于c点 | |
| B. | 图1中a点对应的H2的转化率等于30% | |
| C. | 图2中电极M上发生还原反应 | |
| D. | 图2中电极N的反应式:H2O2+2e-+6H+=2H2O |
分析 A、温度升高二氧化碳的平衡转化率降低,所以平衡逆向移动,则正反应是放热反应;
B、相同条件下,二氧化碳的含量越高,二氧化碳转化率越低;
C、质子向正极移动,所以N是正极,则M是负极;
D、N是正极,发生还原反应,过氧化氢得电子生成水;
解答 解:A、温度升高二氧化碳的平衡转化率降低,所以平衡逆向移动,则正反应是放热反应,所以b点对应的平衡常数K值小于c点,故A错误;
B、相同条件下,二氧化碳的含量越高,二氧化碳转化率越低,所以曲线Ⅰ是两种投料比[$\frac{c(C{O}_{2})}{c({H}_{2}+CO)}$]为1:6,而一氧化碳与氢气的物质的量之比不知,所以无法求氢气的转化率无法,故B错误;
C、质子向正极移动,所以N是正极,则M是负极,所以M发生氧化反应,故C错误;
D、N是正极,发生还原反应,电极反应式为:H2O2+2e-+6H+=2H2O,故D正确;
故选D.
点评 本题主要考查化学平衡移动原理的应用和原电池的工作原理,学生要注意影响化学平衡常数的因素等知识点和电极反应式的书写,难度中等,解题时注意基础的准确运用.


科目:高中化学 来源: 题型:选择题
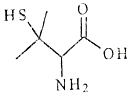
| A. | X的分子式为C5H10NO2S | |
| B. | X有2个手性碳原子 | |
| C. | X能发生加聚反应生成高分子化合物 | |
| D. | X既能与强酸反应,又能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
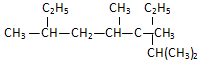 名称2,3,4,6-四甲基-3-乙基辛烷.
名称2,3,4,6-四甲基-3-乙基辛烷.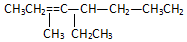 名称:2-甲基-3-乙基-1-戊烯.
名称:2-甲基-3-乙基-1-戊烯.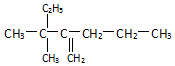 名称:3,3-二甲基-2-丙基-1-戊烯.
名称:3,3-二甲基-2-丙基-1-戊烯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
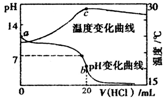
| A. | a点由水电离出的c(H+)<1.0×10-14mol•L-1 | |
| B. | b点时存在c(NH4+)+c(NH3•H2O)=c(C1-) | |
| C. | c点以后溶液温度下降的原因是盐酸的持续加入 | |
| D. | 在整个过程中可能会出现的离子浓度关系:c(NH4+)=c(C1-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题:
下图是部分短周期元素化合价与原子序数的关系图,请回答下列问题: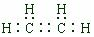 .
. ,A是一种常用的还原剂.向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式4AgBr+N2H4=4Ag+N2↑+4HBr.b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为1:2.
,A是一种常用的还原剂.向装有少量AgBr的试管中加入A的溶液,可观察到固体逐渐变黑,并有气泡产生,写出该反应的化学方程式4AgBr+N2H4=4Ag+N2↑+4HBr.b与c按原子数2和4构成分子B,已知A和B反应时生成无毒害物质,则该反应中氧化剂与还原剂的物质的量之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 操作 | 2小时后Cu2+浸出率/% |
| I | 加入足量0.10mol•L-1 Fe2(SO4)3溶液 | 78.2 |
| II | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,通入空气 | 90.8 |
| III | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,再加入少量0.0005mol•L-1 Ag2SO4溶液 | 98.0 |
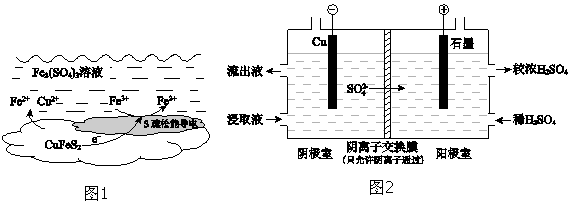
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 军舰船底镶嵌锌块作正极,以防船体被腐蚀 | |
| B. | “天宫二号”使用的碳纤维,是一种新型有机高分子材料 | |
| C. | 烈性炸药硝化甘油是由甘油(丙三醇)硝化制得,它属于酯类 | |
| D. | 蚊虫叮咬时释放出的蚁酸使人觉得不适,可以用肥皂水氧化蚁酸处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 62(a+b)g | B. | 186(a+b)g | C. | (cV-$\frac{a+b}{3}$)mol | D. | (cV-$\frac{9a+b}{3}$)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| B. | 改变温度,产物中NaClO3的最大理论产量为$\frac{1}{7}$amol | |
| C. | 改变温度,反应中转移电子的物质的量n的范围:$\frac{1}{2}$amol≤n≤$\frac{5}{6}$amol | |
| D. | 某温度下,若反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(C{l}^{-})}{c(Cl{O}_{3}^{-})}$=$\frac{11}{2}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com