
分析 先分析反应前后物质化合价的变化,经分析可以得知,反应前后Fe元素的化合价有+3→+6失去3个电子,化合价升3,而Cl元素则有0→-1价,得到1个电子,化合价降1,由于本反应的氧化剂为Cl2,然后依据得失电子守恒结合原子个数守恒写出反应的方程式.
解答 解:依据方程式可知:反应前后Fe元素的化合价有+3→+6失去3个电子,化合价升3,被氧化,而Cl元素则有0→-1价,得到1个电子,化合价降1,氧化还原反应中得失电子应守恒,所以假设Fe(NO3)3前的系数为2,Cl2前的系数为3,再通过质量守恒定律,推断得出该反应的化学方程式即 2 Fe(NO3)3+16 NaOH+3Cl2=2 Na2FeO4 +6 NaNO3 +6 NaCl+8 H2O;每生成8mol H2O即消耗3molCl2转移电子总数为6NA ,
故答案为:2;16;3;2;6;Fe;6NA .
点评 本题考查了氧化还原反应中电子得失守恒、化学方程式配平、转移电子数等知识点,难度一般,检查学生对基础知识的掌握情况.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1 291℃ | 190℃ | 2 073℃ | -107℃ | -57℃ | 1 723℃ |
| A. | 只要由金属元素和非金属元素形成的晶体就一定是离子晶体 | |
| B. | 在共价化合物分子中各原子都形成8个电子的稳定结构 | |
| C. | 金属晶体的熔点不一定比分子晶体的高 | |
| D. | 同族元素的氧化物不可能形成不同类型的晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和FeCl3溶液均能导电,但二者都不是电解质 | |
| B. | 分解反应的生成物中一定有单质 | |
| C. | 分散质粒子的直径在1×10-9~1×10-7cm之间的分散系属于胶体 | |
| D. | 氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO+H2SO4═MgSO4+H2O | B. | Na2O+H2O═2NaOH | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | SO3+H2O═H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的名称为2,2,6-三甲基-4-乙基辛烷.
的名称为2,2,6-三甲基-4-乙基辛烷.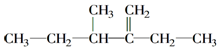 的名称为2-乙基-3-甲基-1-戊稀.
的名称为2-乙基-3-甲基-1-戊稀.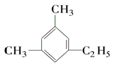 的名称为1,3-二甲基-5-乙基苯.
的名称为1,3-二甲基-5-乙基苯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | X、W能与钠形成摩尔质量相同的化合物,且阴阳离子数比为1:2 | |
| B. | X和Z元素形成的化合物广泛应用于制造集成电路、太阳能电池板等 | |
| C. | 氧化物对应的水化物酸性:W<Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、HCO3-、Cl- | B. | Fe3+、K+、SO42-、I- | ||
| C. | NH4+、Na+、CO32-、NO3- | D. | Cu2+、Na+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
2 mol A与2 mol B混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)  2C(g)+zD(g);若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g);若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=v(D)=0.2 mol·L-1·s-1 B.z=3
C.B的转化率为75% D.反应前与2 s后容器的压强比为4∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com