
| t/min | 0 | 2 | 4 | 6 | 8 | … | 16 | 18 |
| n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | … | … | 1.000 | 1.000 |
| A. | 4-6 min时间段内Z的平均反应速率2.5×10-3 mol/(L•min) | |
| B. | 该温度下此反应的平衡常数K=1.44 | |
| C. | 达平衡后,升高温度,K减小,则正反应△H>0 | |
| D. | 其他条件不变,再充入1.6 mol Z,达新平衡时Z的体积分数不变 |
分析 A.依据图表数据结合反应速率概念计算,V=$\frac{△c}{△t}$计算得到;计算X的反应速率,结合反应速率之比等于化学方程式计量数之比计算Z的反应速率;
B.依据化学平衡三段式列式计算,平衡常数=$\frac{生成物平衡你的幂次方乘积}{反应物平衡浓度幂次方乘积}$;
C.升温平衡逆向进行,正反应为放热反应;
D.反应前后气体体积不变,加入Z相当于增大体系压强,平衡不移动,Z的体积分数不变.
解答 解:A.依据图表数据结合反应速率概念计算,V(X)=$\frac{△c}{△t}$=$\frac{(1.100-1.075)mol}{10L×(6-4)min}$=0.00125mol/L•min,V(Z)=2V(X)=2×0.00125mol/L•min=0.0025mol/L,故A正确;
B.依据化学平衡三段式列式计算,
X(g)+Y(g)?2Z
起始量(mol/L) 0.16 0.16 0
变化量(mol/L) 0.06 0.06 0.12
平衡量(mol/L) 0.1 0.1 0.12
平衡常数=$\frac{生成物平衡你的幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{0.1{2}^{2}}{0.1×0.1}$=1.44,故B正确;
C.升温平衡逆向进行,正反应为放热反应,△H<0,故C错误;
D.反应前后气体体积不变,加入Z相当于增大体系压强,平衡不移动,Z的体积分数不变,故D正确;
故选C.
点评 本题考查化学平衡的计算以及平衡移动的影响,为高频考点,侧重于学生的分析和计算能力的考查,解答本题时注意把握对数据的分析以及计算的思路和方法,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 相同质量、不同密度的N2O 和CO2 | |
| B. | 相同体积、相同密度的CO 和 C2 H4 | |
| C. | 相同温度、相同压强、相同体积的O2和O3 | |
| D. | 相同压强、相同质量的C2H4和C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为0.1mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为0.1mol/L KMnO4标准溶液滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 30.32 | 25.34 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol纯物质完全燃烧时所放出的热量叫做该物质的燃烧热 | |
| B. | 对于任何化学反应,反应的速率越大,反应现象越明显 | |
| C. | SO2溶于水能导电,所以SO2是电解质 | |
| D. | 某溶液的pH=7,则该溶液不一定为中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
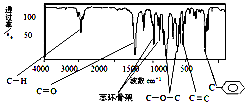
 (不考虑立体异构)
(不考虑立体异构)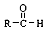 +CH3CHO$\stackrel{稀碱}{→}$
+CH3CHO$\stackrel{稀碱}{→}$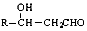 $\stackrel{-H_{2}O}{→}$RCH=CHCHO
$\stackrel{-H_{2}O}{→}$RCH=CHCHO

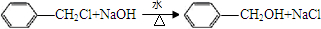
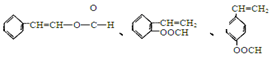
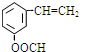 、
、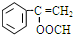 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 1mol/LFeCl3溶液中含有0.1NA个Fe3+ | |
| B. | 1.06g Na2CO3含有的CO32-离子数小于0.01 NA | |
| C. | PH=3的醋酸溶液中,含有的H+数为0.001NA | |
| D. | 2L 0.5mol/L的氨水中,含有NH3•H2O、NH4+、NH3的总数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com