
| A、天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子 |
| B、食用地沟油对人体的危害极大,原因主要是里面含有黄曲霉素和甘油三酯 |
| C、保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
| D、地沟油分子中碳原子数过多,相对分子质量过大是地沟油不宜直接用作燃料油的原因之一 |


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
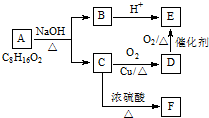
查看答案和解析>>
科目:高中化学 来源: 题型:
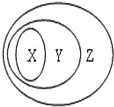 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )| 选项 | X | Y | Z |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 电解质 | 离子化合物 | 化合物 |
| C | 胶体 | 分散系 | 混合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
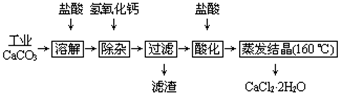
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处,且冷凝水方向应当由下往上 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、提取碘水中的碘单质时,应选择有机萃取剂,且萃取剂与水不互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
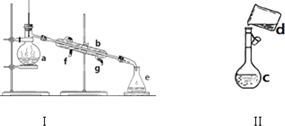
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com