
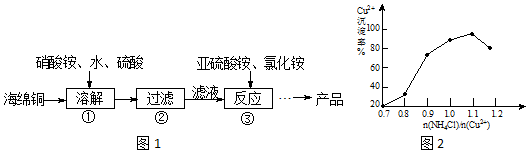
分析 酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的产品CuCl,经硫酸酸洗,水洗后再用乙醇洗涤,烘干得到氯化亚铜,据此分析.
解答 解:酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,烘干得到氯化亚铜.
(1)溶解温度应控制在60-70℃,原因是温度低溶解速度慢,温度过高铵盐分解;
故答案为:温度低溶解速率慢,温度过高铵盐分解;
(2)步骤③中铜离子与亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,当氯化铵用量增加到一定程度后氯化亚铜的沉淀率减少,原因是生成的氯化亚铜又溶解于氯化铵溶液中;
故答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+;生成的CuCl又溶解于氯化铵溶液中;
(3)不断摇动玻璃珠的目的是加速样品的溶解;
故答案为:加速样品溶解;
n(Cr2O72-)=0.05mol•L-1×1.6×10-2L=8×10-4mol
6CuCl--------------------------Cr2O72-
6 1
n (CuCl) 8×10-4mol
n (CuCl)=4.8×10-3mol
ω(CuCl)=$\frac{4.8×1{0}^{-3}mol×99.5g/mol}{0.5g}×100%$=95.52%;
答:CuCl纯度为95.52%.
点评 本题考查物质的制备实验,为高频考点,侧重于学生的分析能力、实验能力的考查,注意把握物质的性质以及反应流程,题目难度中等,注意习题中信息应用.


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
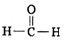 )中含有的共用电子对总数为2NA
)中含有的共用电子对总数为2NA| A. | ①④ | B. | ③④ | C. | ②⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2L | B. | 5.6L | C. | 8.4L | D. | 14L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将pH=5的HCl 溶液稀释1000倍后pH变为8 | |
| B. | 将pH=8的NaOH溶液稀释1000倍后pH变为6 | |
| C. | 将 pH=2的HCl 溶液加热蒸发,体积变为原来的$\frac{1}{10}$,pH变为1 | |
| D. | 将pH=3的醋酸溶液稀释100倍后,pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入肥皂液产生浑浊的水是硬水 | |
| B. | 软水不一定是纯水 | |
| C. | 硬水中的钙、镁离子通过加热煮沸可以完全沉下 | |
| D. | 硬水加入石灰一纯碱后生成Mg(OH)2和CaCO3沉淀;利用离子交换剂也可把硬水软化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨是指pH<5.6的雨水 | |
| B. | 二氧化碳大量排放会造成温室效应 | |
| C. | 白色污染会造成“水华”和“赤潮” | |
| D. | 燃煤中掺入生石灰能有效减少SO2的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
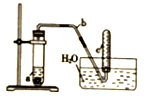 用图示简易装置可以进行某些氮氧化物气体的制取、收集及性质检验.
用图示简易装置可以进行某些氮氧化物气体的制取、收集及性质检验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| B. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com