
| 1mol |
| 0.75mol |
| 4 |
| 3 |
|
|


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、500mL,1mol/L MgCl2溶液中含有Cl-数目为0.5NA |
| B、14g氮气所含的N原子数为NA个 |
| C、标准状况下,22.4L水所含的H2O分子数为NA个 |
| D、在钠与氯气的反应中,1mol钠失去电子的数目为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
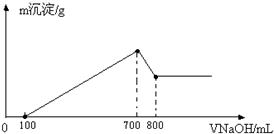 将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/L NaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示.求:
将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/L NaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示.求:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、abXn-含有的中子数为a+b | ||
B、X原子的质量约为
| ||
| C、X原子的质量数为a+b+n | ||
| D、abXn-含有的电子数为a-n |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质类别 | 分类依据 | |
| A | 酸 | 电离时能否产生氢离子 |
| B | 碱性氧化物 | 是否属于金属氧化物 |
| C | 胶体 | 能否发生丁达尔现象 |
| D | 强电解质 | 水溶液中能否完全电离 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
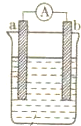 如图为某化学兴趣小组进行不同条件下化学能转变为电能探究的装置.请你回答下列问题:
如图为某化学兴趣小组进行不同条件下化学能转变为电能探究的装置.请你回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com