
下列操作对实验结果没有影响的是( )
A.在氯乙烷里加入NaOH溶液水解后,立即加入AgNO3溶液,能证明有氯离子生成
B.在淀粉溶液中加入20%的稀硫酸水解后,立即加入银氨溶液做银镜反应实验,能证明有葡萄糖生成
C.在硫酸铜溶液中加入几滴NaOH溶液振荡,立即加入麦芽糖溶液并加热,能证明麦芽糖具有还原性
D.在乙醇溶液中插入一根红热的铜丝,能证明醇氧化成醛
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:阅读理解
| 方案 | 操作 | 结论 |
| 甲 | 分别加入到盛水的试管中 | 放热者为浓硫酸 |
| 乙 | ||
| 丙 | ||
| 丁 |
| 分组 | 第一小组 | 第二小组 |
| 抽气时间 | 20分钟 | 21分钟 |
| 抽气次数 | 100 | 130 |
| SO2含量mg/m3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
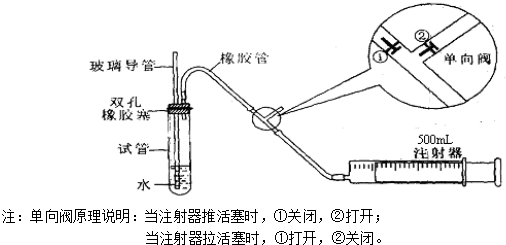
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是__________(填分子式)。产生这种结果的主要原因足(用离子方程式表示) ______________________。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学没计了如下实验,对气体X取样进行认真探究。
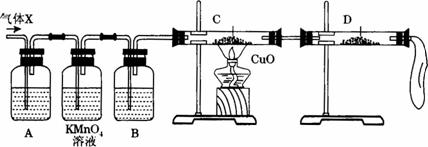
①组装好仪器后,盛放药品前,必要的一个操作是___________________________________。
②A中加入的试剂可能是__________________,作用是____________________________。
B中加入的试剂可能是____________________,作用是____________________________。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是______________,D中最好选择的试剂是______________________。
(3)假定气体在吸收过程中吸收完全,对上述装置略加改进,可以粗略测定气体X中SO2的体积分数。改进时可选用的下列仪器为__________________(填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)现行高中化学课本第一册的学生实验一中设计了CuO对KClO3分解的催化作用的实验,某化学兴趣小组对此产生了兴趣,研究CuO和MnO2对KClO3分解的催化性能。
实验装置:

图4-3
实验记录:
实验序号 | 试管中药品 | 加热时间 | 待测数据 |
1 | 20s |
| |
2 | 20s |
|
问题与讨论
①这里的待测数据是__________________________;
②测气体的体积,是选装置(Ⅰ)还是选装置(Ⅱ)?__________________________;
③实验开始时,是先把导管通入量筒中,还是先加热?理由是什么?
____________________________________________________________________
④实验时间到后,应如何操作?
____________________________________________________________________
(2)已知下列反应:2H2O2+2KMnO4+3H2SO4=K2SO4+MnSO4+5O2↑+8H2O。学生在做此实验时发现:在敞口容器中,当H2O2与酸化的KMnO4溶液混合后,开始产生氧气的速率很慢,一段时间后产生氧气的速率很迅速,经测定溶液的温度基本没变,该学生经过思考认为不可能是温度、浓度、压强的影响,只可能是催化剂的影响。为了证实自己的推断,设计了以下对比实验:
①空白实验 ②起始时加入少量K2SO4固体
③起始时加少量______________ ④起始加入少量水
实验结果:起始反应速率③最快,④最慢,①②基本相同
请解释实验①过程中现象产生的原因:_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com