
【题目】下列气体能用向上排气法收集的是
A. NH3 B. H2 C. NO D. CO2
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g) ![]() xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2
xC(g) △H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2
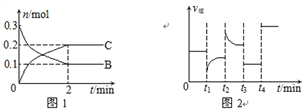
下列有关说法正确的是
A. x=2,反应开始2 min内,v(A)=0.05 mol/(L·min)
B. t1时改变的条件是降温,平衡逆向移动
C. t2时改变的条件可能是增大C的浓度,t2时正反应速率减小
D. t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6mol/L,现有几种说法:
2C(g)。若经2s后测得C的浓度为0.6mol/L,现有几种说法:
①用物质A表示的反应的平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s )
③2s时物质A的转化率为70% ④2s时B物质的浓度为0.7 mol/L
其中正确的是( )
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 将AlCl3溶液加热蒸干得到纯净的氯化铝晶体 B. 强电解质都易溶于水,所以BaSO4是弱电解质
C. 强酸溶液一定比弱酸溶液导电性强 D. 电解质溶液的导电过程会发生化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
混合物 | 化合物 | 单质 | 盐 | |
A | NaOH溶液[_K] | 盐酸 | 石墨 | 食盐 |
B | 澄清石灰水 | KNO3晶体 | O3 | 纯碱(Na2CO3) |
C | 空气 | 石灰石 | 铁 | 消石灰 |
D | CuSO4·5H2O | CaCl2 | 水银 | CaO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的本质是旧化学健的断裂和新化学键的形成。已知某些化学键的键能数据如下:
化学键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 243 | 431 |
则下列热化学方程式不正确的是( )
A. ![]() H2(g)+
H2(g)+![]() Cl2(g)===HCl(g)
Cl2(g)===HCl(g)
ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1
C. ![]() H2(g)+
H2(g)+![]() Cl2(g)===HCl(g)
Cl2(g)===HCl(g)
ΔH=+91.5 kJ·mol-1
D.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,0.01 mol·L-1 MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱稀溶液反应的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A.-69.4 kJ·mol-1
B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1
D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答下列问题:
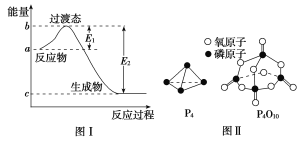
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是__________________________。
请写出NO2和CO反应的热化学方程式:______________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g)
O2(g)===CO2(g)+2H2(g)
ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为______________________________。
(3)下表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/(kJ·mol-1) | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=________kJ·mol-1(用含a、b、c、d的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com