
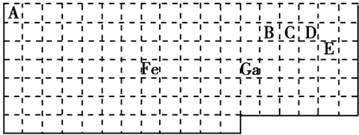
分析 (1)Ga位于第四周期第IIIA族,最外层有3个电子;
(2)元素周期表五区的划分是根据最后排入的电子名称命名的;根据化合物的化合价代数和为0分析;
(3)价电子数相同和原子数相同的微粒互称等电子体;
(4)先根据价层电子对互斥理论判断价层电子对,然后再确定采取的杂化方式;
(5)价层电子对数=σ键电子对数+中心原子上的孤电子对数,根据价层电子对数判断微粒构型;根据元素周期表知,B、C、D、E分别是C、N、O、Cl是四种元素,若化合价的绝对值+原子最外层电子数=8,分子中每个原子最外层都达到8电子稳定结构,据此分析.
解答 解:(1)Ga位于第四周期第IIIA族,最外层有3个电子,其最外层电子排布式为4s24p1;
故答案为:4s24p1;
(2)元素周期表五区的划分是根据最后排入的电子名称命名的.Fe原子是26号元素,Fe原子的基态核外电子排布式为:1s22s22p63s23p63d64s2,
这些电子排列时遵循能量最低原理(先排能量低的后排能量高的),这些能级的能量大小顺序为:1s<2s<2p<3s<3p<4s<3d,
根据能量最低原理先排4s电子后排3d电子,所以 最后排入的是3d电子,根据命名规则属d区,根据化合物化合价的代数和为0,Fe与CO易形成配合物Fe(CO)5化合价的代数和为0,CO的化合价的代数和为0,
故答案为:d;0;
(3)根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等.对于原子,原子序数=原子核外电子总数,所以,如果是分子,只要原子序数之和相等即可.CO中C是6号元素,O是8号元素,原子序数之和为14,N是7号元素,且可形成双原子分子,所以分子是N2.
故答案为:N2、CN-;
(4)在CH4中价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化.在CO分子中价层电子对数=σ键电子对数(1)+中心原子上的孤电子对数(1),所以碳原子采取sp杂化.CH3OH中,价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化.
故答案为:CH4、CH3OH;
(5)根据元素周期表知,E是Cl元素,D是O元素,ED4-是ClO4-离子,价层电子对数=σ键电子对数+中心原子上的孤电子对数,价层电子对数=4+$\frac{1}{2}$(7+1-4×2)=4,根据VSEPR理论预测ED4-离子的空间构型为正四面体型.
C、N、O、Cl是四种元素,两两形成的化合物且每个原子最外层都达到8电子稳定结构的化合物有:CO2、N2O3、CCl4;
故答案为:正四面体;CO2、N2O3、CCl4.
点评 本题考查基态原子或离子的核外电子排布或最外层电子排布、分子中原子采取的杂化方式、对于元素周期表,学习时要记住它的周期、族的划分,要熟记前36号元素,五区的划分、边界、划分依据等都要掌握,在学习中要灵活掌握根据VSEPR理论预测分子或离子的空间构型是学习的重点,也是近几年高考的热点.


科目:高中化学 来源: 题型:选择题
| A. | 0.4△H1+0.05△H3 | B. | 0.4△H1+0.05△H2 | C. | 0.4△H1+0.1△H3 | D. | 0.4△H1+0.2△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
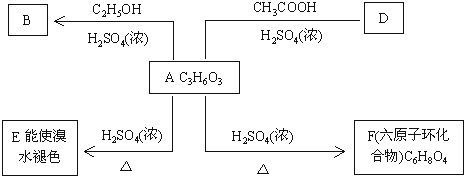

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式 | B. | Cl-的结构示意图: | ||
| C. | 乙烯的结构简式C2H4 | D. | Z质量数为37的氯原子${\;}_{37}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO:0.06mol•L-1 | B. | H2O:0.002mol•L-1 | ||
| C. | NH3:0.002mol•L-1 | D. | O2:0.00125mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或 最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F 是前四周期原子电子轨道表示式中单电子数最多的元素 |
| G在周期表的第十一列 |
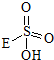 →
→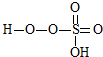 +HE,请写出横线上物质的结构式.
+HE,请写出横线上物质的结构式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (X为卤素原子)
(X为卤素原子) 的物质,该物质是一种香料.请根据下述路线,回答下列问题:
的物质,该物质是一种香料.请根据下述路线,回答下列问题:
 .
. .
.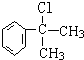 的水解产物
的水解产物 不能经氧化反应⑥而得到产品,导致产率低.
不能经氧化反应⑥而得到产品,导致产率低. 等.
等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com