
【题目】过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤。正确的操作顺序是 ( )
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】“2015·8·12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)根据价键规则,写出H2CO3的结构式__________。
(2)下列能用于判断氮、碳两种元素非金属性强弱的是_________(填序号)
a. 气态氢化物的稳定性强弱 b. 最高价氧化物对应水化物酸性强弱
c. Al2O3+N2+3C=2AlN+3CO d. 比较在周期表中的位置
(3)0.01mol/L的NaCN溶液pH=9,用离子方程式表示呈碱性的原因_______。 请判断该溶液中:c(CN-)__c(OH-)(填“>”、“<”或“=”)
(4)含CN-的污水危害很大,处理该污水时,可在催化剂TiO2作用下用NaClO将CN-氧化成CNO-。CNO-在酸性条件下继续被NaClO氧化生成N2与CO2。某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率。

将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol/L)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为___________,乙中反应的离子方程式为________。
②上述实验是通过测定CO2的量来确定CN-的处理效果。若丙中的试剂是饱和食盐水,且丙、丁都是除杂装置,则乙中产生的气体除CO2、N2外,还可能含有的杂质气体是__________,戊中盛有足量的石灰水,若实验后戊中生成0.9g沉淀,则CN-被处理的百分率为_________。
(5)装置中碱石灰的作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对四组无色透明溶液进行离子检验,四位同学各鉴定一组,他们的实验报告的结论如下,其中可能正确的是
A. MnO4—、K+、S2—、Na+ B. Mg2+、NO3—、OH—、Cl—
C. K+、H+、Cl—、CO32— D. Na+、OH—、Cl—、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,化学实验室产生的废液必须经处理后才能排放。某化学实验室产生的酸性废液中含有Fe3+、Cu2+、Ba2+三种金属阳离子和Cl-一种阴离子,实验室设计了下述方案对废液进行处理,以回收金属并测定含量,保护环境。
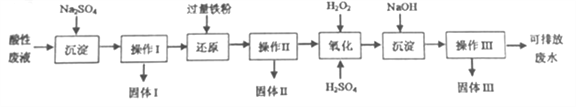
已知实验中处理的酸性废液的体积为1L,用pH计测定出其中H+物质的量浓度为0.10mol/L。
请回答下列问题:
(1)实验中操作I、II、III的方法相同,操作步骤依次为过滤、_________、干燥。
(2)“氧化”步骤所得溶液颜色为棕黄色,该反应的离子方程式为:__________。
(3)实验中称量固体I 的质量为4.66g,固体II 的质量为15.2g,用足量的稀硝酸溶解固体II 后产生了标准状况下的无色气体4.48L,则固体II 中金属铜的质量为________g。
(4)实验中将固体III进行充分灼烧,使用仪器除了酒精灯、三脚架、泥三角、玻璃棒外,还有_____(填名称)。最后得到的红棕色固体质量为40.0g,则原溶液中氯离子的物质的量浓度为________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理示意图如下。下列说法正确的是
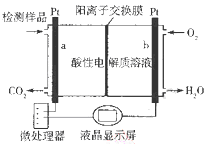
A.该装置为电能转化为化学能的装置
B.a电极发生的电极反应为CH3OH+H2O-6e-═CO2↑+6H+
C.当电路中有1 mol e-转移时,正极区n(H+)增加1 mol
D.将酸性电解质溶液改为碱性电解质溶液该测试仪不可能产生电流
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

(1)从反应开始到10 s时,用Z表示的反应速率为_____________________________。
(2)该反应的化学方程式为__________________________________________________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号,下同)。
2SO3(g)达到平衡状态的是_______(填序号,下同)。
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 ____________。
2HI(g)达到平衡状态的是 ____________。
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是_________。
C(g)+D(g)达到平衡状态的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液退色;②比例模型为 |
B | ①由C和H两种元素组成;②比例模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
①A与Br2的CCl4溶液反应的生成物的名称是________________。
②B不能使溴水因发生化学反应而褪色,B与一定比例浓硫酸和浓硝酸的混合溶液发生反应,为了使反应在50~60 ℃下进行,常用的方法是_____________;反应方程式为: ________________________________,反应类型为:________反应。
③C和D反应生成相对分子质量为100的酯,生成的酯的结构简式:______。
(2)已知: A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;由A通过聚合反应生成高分子化合物F,F可用于工业合成塑料,现以A为主要原料合成G, 以A为原料的合成路线如下图所示。
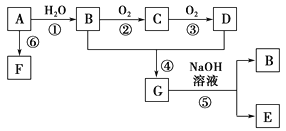
回答下列问题:
①D、G分子中的官能团名称分别__________、___________。
②在反应①~⑥中,属于加成反应的是________,属于取代反应的是________。(填序号)
③写出与G分子式相同的所有羧酸类的同分异构体:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com