
| A. | 苯与浓硫酸反应 | B. | 乙醇与HBr溶液共热制溴乙烷 | ||
| C. | 乙醇和浓硫酸共热至170℃ | D. | 油脂与强碱水溶液反应 |
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:多选题
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>Y>X | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物对应的水化物的碱性:Y>R>X | |
| D. | 相同条件下,等物质的量的单质与氢气化合放出能量的多少:T>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的热化学方程式M(g)+3N(g)?2R(g)△H>0 | |
| B. | 达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 | |
| C. | 达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小 | |
| D. | 达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述四种氧化物对应的水化物中,Al(OH)3酸性最强 | |
| B. | 向沉淀X中逐滴加入硝酸,沉淀慢慢溶解 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g46%的乙醇溶液所含氢原子数为1.2 NA | |
| B. | 0.5 mol Na2O2中含有的离子数目为2NA | |
| C. | 标准状况下,2.24 L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4 g,其中所含硫原子数为1.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
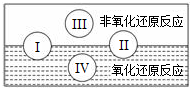 氧化还原反应在生产、生活中具有广泛的用途、贯穿古今.
氧化还原反应在生产、生活中具有广泛的用途、贯穿古今.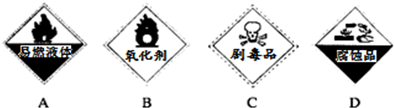
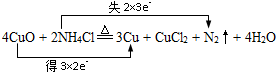 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com