
下面关于Na2CO3和NaHCO3性质的叙述,正确的是
A.受热时NaHCO3比Na2CO3稳定
B.在水中NaHCO3比Na2CO3溶解性大
C.质量相等的Na2CO3和NaHCO3分别与足量盐酸反应,NaHCO3放出的CO2比Na2CO3多
D物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应,放出CO2的物质的量之比为2:1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
固体A的化学式为NH5,能跟水反应,它的所有原子的电子层结构都跟与该原子同周期的稀有气体原子一样,则下列说法中,不正确的是( )
A. NH5中既有共价键、又有离子键,是离子化合物
B. 1molNH5中有5NA个N—H键(NA为阿伏加德罗常数)
C.NH5跟水的反应是氧化还原反应
D.NH5跟水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于苯酚的叙述不正确的是( )
A.苯酚是一种弱酸,滴加指示剂变色
B.苯酚在水溶液中能按下式电离:
C.苯酚钠在水溶液中几乎不能存在,会水解生成苯酚,所以苯酚钠溶液显碱性
D.苯酚有腐蚀性,溅在皮肤上可用酒精冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。
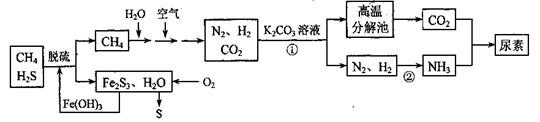
请回答下列问题:
(1)反应①的离子方程式是__________ ____
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是__ _____。
(3)反应②N2+3H2 2NH3 △H<0,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不 变”)。如 该反应在恒容恒温条件下进行,下列说法能判断达到平衡的是 。
2NH3 △H<0,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不 变”)。如 该反应在恒容恒温条件下进行,下列说法能判断达到平衡的是 。
A.单位时间内生成nmol N2同时消耗3nmol H2 B.混合气体的密度不变
C.混合气体的平均摩尔质量不变 D. N2、H2、NH3浓度之比为1:3:2
(4)H2NCOONH4 (氨基甲酸铵)是合成尿素的中间体,H2NCOONH4在水溶液中要发生水解反应,其水解反应的离子方程式为:____ __。
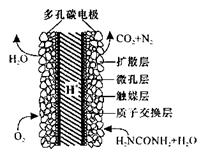 (5)如果整个生产过程釆用绿色化学工艺,则生产120t尿素理论上需要CH4__ _m3 (标准状况)。
(5)如果整个生产过程釆用绿色化学工艺,则生产120t尿素理论上需要CH4__ _m3 (标准状况)。
(6) 化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为______ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列反应中,水仅作还原剂的是( )
A.Na2O+H2O=2NaOH B.2F2+2H2O=4HF+O2
C.Cl2+H2O=HCl+HClO D.2K+2H2O=2KOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
将2.56 g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12 L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05 mol B.1 mol C.1.05 mol D.0.13 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是
A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
B.使用生物酶降解生活废水中的有机物,可防止水体的富营养化
C.上海世博会很多展馆采用光电转化装置,体现当今“低碳”经济的理念
D.利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤。请回答下列问题:
⑴ 该反应在恒温恒容密闭容器中进行,判断其达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
⑵ 某温度下,2SO2(g)+O2(g) 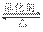 2SO3(g) △H=-196 kJ•mol-1。
2SO3(g) △H=-196 kJ•mol-1。
在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,
半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol•L-1•min-1,放出的热量为 kJ。
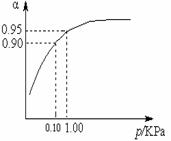 ⑶ 一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。试分析工业生产中采用常压的原因是 。
⑶ 一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。试分析工业生产中采用常压的原因是 。
⑷ 将一定量的SO2和0.7 molO2放入一定体积的密闭容器中,在550℃和催化剂作用下发生反应。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。则该反应达到平衡时SO2的转化率是多少?(要写出计算过程,计算结果保留一位小数。)
查看答案和解析>>
科目:高中化学 来源: 题型:
在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+  O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)= S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
③H2S(g)+ O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
A.△H4=2/3(△H1+△H2-3△H3)
B.△H4=2/3(3△H3-△H1-△H2)
C.△H4=3/2(△H1+△H2-3△H3)
D.△H4=3/2(△H1-△H2-3△H3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com