
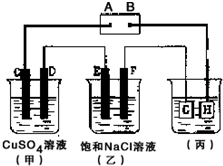
 如图所示的装置,C、D、E、F 都是惰性电极.将电源接通后,观察到甲中C电极上有红色固体析出,电解一段时间后,C电极质量增加19.2g,试回答以下问题:
如图所示的装置,C、D、E、F 都是惰性电极.将电源接通后,观察到甲中C电极上有红色固体析出,电解一段时间后,C电极质量增加19.2g,试回答以下问题:分析 (1)C电极上有红色固体析出,说明C(Cu)作阴极发生还原反应,电解池的阴极与电源的负极相连,A是甲醇燃料电池的负极,失电子发生氧化反应;再根据电子转移守恒计算;
(2)电解甲溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜;
(3)电解饱和食盐水时,氢离子在阴极(与电源负极相连),即E电极发生得电子的还原反应;电解饱和食盐水生成氢气、氯气、氢氧化钠;
(4)电镀时,镀层作阳极,镀件作阴极,电解质溶液中的金属元素与阳极材料所含元素相同.
解答 解:(1)C电极上有红色固体析出,说明C(Cu)作阴极发生还原反应,电解池的阴极与电源的负极相连,A是甲醇燃料电池的负极,失电子发生氧化反应,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O;C电极质量增加19.2g,Cu2+~2e-~Cu,转移电子的物质的量为$\frac{19.2g}{64g/mol}$×2=0.6mol,则反应的甲醇的物质的量为0.1mol,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;0.1mol;
(2)电解甲溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,所以电池反应式为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
(3)电解饱和食盐水时,氢离子在阴极(与电源负极相连),即E电极发生得电子的还原反应,电极反应式为:2H++2e-=H2↑;电解饱和食盐水生成氢气、氯气、氢氧化钠,总反应式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,
故答案为:2H++2e-=H2↑;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑;
(4)在铜上镀银时,G与电源负极相连作阴极,说明G是铜,镀层银作阳极,电解质溶液是硝酸银溶液,故答案为:Cu;AgNO3.
点评 本题考查了原电池及电解原理,准确判断电极名称和电解池溶液中阴阳离子的放电顺序是解本题的关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:4 | C. | 4:1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,溶液中离子浓度都减小 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol•L-1CH3COOH溶液,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,电离平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电镀时,电镀池里的阳极材料发生氧化作用 | |
| B. | 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 | |
| C. | 惰性电极电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 | |
| D. | 电解熔融的氧化铝制取金属铝,用铁作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 微粒Na+、Mg2+、O2-具有相同的电子层结构 | |
| C. | 短周期第ⅣA与ⅥIA族元素的原子间构成的分子,均满足原子最外层8电子结构 | |
| D. | ${\;}_{20}^{48}$Ca2+的中子数比核外电子数多10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物的分子式为C11H14O3 | |
| B. | 该有机物可能易溶于水且具有水果香味 | |
| C. | 该有机物可能发生的化学反应类型有:水解、酯化、氧化、取代 | |
| D. | 1mol该有机物在Ni作催化剂的条件下能与4molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成氢气是HCl溶液多 | |
| B. | 生成氢气是CH3COOH溶液多 | |
| C. | 反应速率是HCl溶液与锌反应的快 | |
| D. | 反应速率是CH3COOH溶液与锌反应的快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com