
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMO4溶液 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
分析 (1)根据反应方程式及化学平衡常数表达式完成;根据表中数据,温度升高,化学平衡常数增大进行判断;
(2)根据化学平衡常数表达式计算解答;
(3)令CO的浓度变化为c,用三段式表示出各物质变化的浓度、平衡时的浓度,再根据平衡常数计算,比较浓度商与平衡常数K的关系;
(4)根据化合价升降相等,来配平即可得出答案;
(5)研究反应物浓度对化学反应速率的影响,其条件不变的情况下只改变温度.
解答 解:(1)根据反应CO(g)+H2O(g)?H2(g)+CO2(g)及化学平衡常数表达式,K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}0)}$,由于温度升高,该反应的化学平衡常数减小,平衡向着逆向移动,正向反应是放热反应,所以△H<0,故答案为:K=$\frac{c({H}_{2})•c(C{O}_{2})}{c(CO)•c({H}_{2}0)}$;<;
(2))①C(s)+CO2(g)?2CO(g)平衡常数K1;
②C(s)+H2O(g)?CO(g)+H2(g)平衡常数K2;
③CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K;
③=②-①,故K=$\frac{{K}_{2}}{{K}_{1}}$,
故答案为:K=$\frac{{K}_{2}}{{K}_{1}}$;
(3)对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.04 0.16 0 0
变化(mol/L):c c c c
平衡(mol/L):0.04-c 0.16-c c c
所以$\frac{c×c}{(0.04-c)(0.16-c)}$=9,解得c=0.032
所以CO的转化率为$\frac{0.032mol/L}{0.04mol/L}$×100%=80%.
则平衡时各量为:
对于反应 CO(g)+H2O(g)?H2(g)+CO2(g),
开始(mol/L):0.04 0.16 0 0
变化(mol/L) 0.032 0.032 0.032 0.032
平衡(mol/L):0.008 0.128 0.032 0.032
改变后的量为:CO(g)+H2O(g)?H2(g)+CO2(g),
改变后(mol/L):0.018 0.128 0.032 0.072
Qc=$\frac{0.032×0.072}{0.018×0.128}$=1=K,所以平衡不移动,
故答案为:80%;=;
(4)H2C204中碳由+3价变为+4价,升高1×2;而锰由+7变为+2,降低5价;升降守恒,所以最小公倍数为5;即n(H2C204):n(KMnO4)≥2.5,故答案为:≥2.5;
(5)只改变草酸的浓度,而混合溶液的体积不变,进行对照试验,探究浓度对反应速率的影响,实验①溶液的体积是13mL,所以x=2ml,故答案为:2;保证其它条件不变,只改变H2C2O4的浓度,从而达到对比的目的.
点评 本题考查平衡常数及其相关计算、平衡移动原理、平衡标志的判断等,根据平衡常数求转化率,题目难度中等,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:多选题
 X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )| A. | 化合物XZ3中各原子均满足8电子的稳定结构 | |
| B. | X,Y,Z三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z单质可与Y的氢化物发生置换反应 | |
| D. | X3-与Al3+有相同的电子数,前者只有氧化性,后者只有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
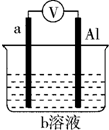 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.已知:
T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增.已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全氟丙烷不能使溴水褪色 | |
| B. | 全氟丙烷的电子式为: | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 分子中三个碳原子可能处于同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑧ | B. | ③⑩ | C. | ①⑥ | D. | ②⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com