
下列表示对应反应的离子方程式正确的是
A.用过氧化氢从酸化的海带灰浸出液中提取碘:2I—+H2O2+2H+==I2+2H2O
B.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O==AgOH↓+NH4+
C.碳酸氢钠的水解:HCO3— +H2O CO32— +H3O+
CO32— +H3O+
D.用惰性电极电解氯化镁溶液:2Cl—+2H2O H2↑+Cl2↑ +2OH—
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3·H2O ⑤CH3COONa ⑥NH4Cl ⑦C2H5OH ⑧SO2
(1)属于弱电解质的是 ,溶液呈碱性的有 (填序号)。
(2)常温下0.01 mol/L NaOH溶液的pH= ;pH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
mol/L NaOH溶液的pH= ;pH=11的CH3COONa溶液中由水电离产生的c(OH-) = 。
(3)用离子方程式表示CH3COONa溶液呈碱性的原因 ,其溶液中离子浓度按由大到小的顺序为 。
 (4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
(4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
①由图中信息可知HA为_______酸
(填“强”或“弱”)。
②在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”)
③K点对应的溶液中, c(M+)+c(MOH)= mol·L-1。
(5)在25 ℃下,向浓度均为0.01 mol·L-1的FeCl3和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),当测得溶液pH=11时,则此温度下残留在溶液中的c(Cu2+):c(Fe3+)
= 。
(已知25℃时Ksp[Fe(OH)3]=4.0×10-38, Ksp[Cu(OH)2]=2.2×10-20)
(6)25℃时,将bmol NH4NO3溶于水,向该溶液滴加aL氨水后溶液呈中性,则所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数取Kb = 2×10-5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
下表列出了某冷轧厂排放的废水中各成份的含量及国家环保标准值的有关数据:
| 冷轧含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO42-浓度/(mg·L-1) | ≤23 000 | ≤150 |
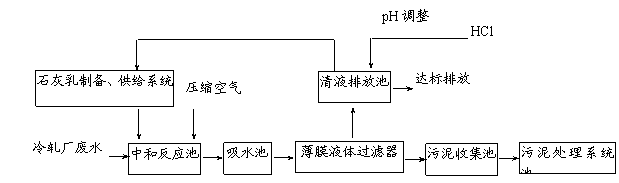 某科研机构为该厂量身定做,设计了如下废水处理系统,不但节约大量工业用水,而且大大降低了生产成本。
某科研机构为该厂量身定做,设计了如下废水处理系统,不但节约大量工业用水,而且大大降低了生产成本。
请回答下列问题:
⑴ 向中和反应池中通入压缩空气的作用是 ▲ 。
⑵ 若废水中细菌含量较高,往往用漂白粉代替石灰乳沉淀Zn2+,漂白粉沉淀Zn2+的离子方程式是
▲ 。
⑶ 污泥处理系统除去污泥后,可得到的工业副产品有 ▲ (填化学式)。
⑷ 薄膜液体过滤器是将膨体聚四氟乙烯专利技术与全自动控制系统完美地结合在一起的固液分离设备。为提高薄膜液体过滤器的过滤能力,废水处理系统工作一段时间后,需要对薄膜进行化学处理,薄膜定期处理的方法是 ▲ 。
⑸ 经上述工艺处理后的废水pH=8,此时废水中Zn2+的浓度为 ▲ mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17), ▲ (填“符合”或“不符合”)国家环保标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
B.硫粉在过量的氧气中燃烧可以生成SO3
C.将少量SO2通入BaCl2溶液能生成白色沉淀
D.将浓盐酸、浓硝酸和浓硫酸分别露置在空气中,溶质的物质的量浓度都降低
查看答案和解析>>
科目:高中化学 来源: 题型:
铝热反应常用于冶炼高熔点的金属, 可简单认为是铝与某些金属氧化物在高温条件下发生的反应。某学习小组对铝热反应(以Al和Fe2O3反应为例)实验进行研究。
查阅数据得到Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下表所示:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1565 |
| 沸点/℃ | 2467 | 2980 | 2750 | ┄ |
试回答下列问题:
(1)在铝热反应中金属铝表现出 性(填“氧化”或“还原”)。请判断下列金属中那一个不能由铝热反应制取 。(填序号)
①Fe ②Cr(铬) ③V(钒) ④Ca ⑤Mn
(2)某同学推测,铝热反应所得到的熔融物中应含有铁、铝两种金属。如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为 ,可观察到的实验现象是 。
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色未变血红色,即可证明熔融物中不含有Fe2O3。则
①物质甲是 (填化学式)。
②该同学的实验方案是否合理? (填“合理”或“不合理”)。
理由:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。

请回答下列问题:
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(III)的化学方程式 。
(2)若D为氯碱工业的重要产品,A、B、C为均含有同一金属元素的无机化合物,反应(III)的离子方程式为 。
(3)若B为非金属单质,且B所含元素的原子最外层电子数与内层电子数之和的比值为3:5,则反应(III)中氧化产物与还原产物的物质的量之比为 。0.1mol A与含0.15 mol NaOH的溶液充分反应后,溶液中所含离子浓度的大小关系为 。
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一。
①A中所含化学键类型为 ,D的电子式为 。
②25℃时,0.1mol·L-1 B、C溶液,pH较大的是 溶液(填溶质的化学式),写出B溶液中微粒浓度之间存在的等量关系 (写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是:
A.有机化合物分子中的某个原子(或原子团)被另一个原子(或原子团)所替代的反应,叫取代反应
B.结构相似,分子组成相差1个或若干个“CH2”原子团的有机物互称为同系物
C.从煤焦油中分离出苯、甲苯、二甲苯等有机物的过程为化学变化
D.塑料、合成纤维、合成橡胶统称为三大合成材料
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式不正确的是
A.向NH4HCO3溶液中加入过量烧碱溶液:NH4+ +OH-= NH3↑+H2O
B.将CO2通入到纯碱饱和溶液中:2Na++CO32-+CO2+H2O=2NaHCO3↓
C.向Ba(OH)2溶液中加入足量的KHSO4溶液:Ba2+ +2OH-+2H++ SO42- = BaSO4↓+2H2O
D.将饱和FeCl3溶液滴入沸水中制胶体:Fe3+ + 3 H2O Fe(OH)3(胶体) +3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化可用同一原理解释的是
A.氯水和SO2可使品红褪色 B.氯水和活性炭使红墨水褪色
C.浓硫酸和浓盐酸长期暴露在空气中浓度降低
D.氢氧化钠溶液和石灰水暴露在空气中变质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com