
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少许样品于试管中,加 |
有无色气体产生,说明样品中含有Na2CO3. |
| ② | 有白色沉淀产生,则含Na2SO4 | |
| ③ |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 加蒸馏水溶解,加足量的1.0 mol?L-1HNO3 | |
| ② | 向试管中加入0.1mol?LBa(NO3)2溶液 | |
| ③ | 继续向②中的试管中加入0.1mol?LBa(NO3)2溶液至没有沉淀生成为止,将试管静置片刻后,取上层清液与另一试管中加入0.1mol?L-1AgNO3溶液 | 有沉淀产生,则含NaCl,若无沉淀,则不含NaCl. |


科目:高中化学 来源: 题型:
| A、22.4 L NO2气体中含有的分子数为NA |
| B、16 g O2中含有的氧原子数为NA |
| C、0.1 mol/L NaCl溶液中,含有的Na+ 数为NA |
| D、标准状况下,22.4 L 硫单质中含有的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液与氢氧化钠溶液反应:H++OH-=H2O |
| B、铝与烧碱溶液反应:Al+2H2O+OH-=AlO2-+2H2↑ |
| C、碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、向偏铝酸钠溶液中通入少量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
. |
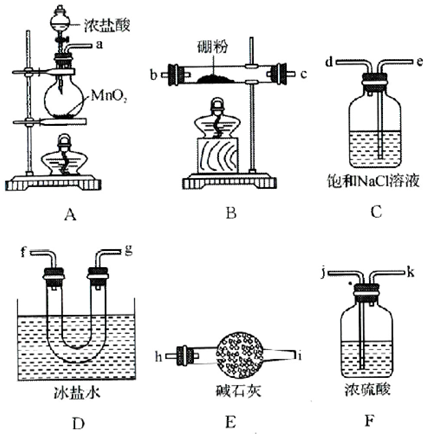
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某金属A及其化合物之间有如下的转化关系
某金属A及其化合物之间有如下的转化关系查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com