
【题目】在一定温度下,将2molSO2和1mol O2充入一定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-197kJ·mol-1,当达到化学平衡时,下列说法中正确的是( )
2SO3(g)ΔH=-197kJ·mol-1,当达到化学平衡时,下列说法中正确的是( )
A.SO2和SO3共2molB.生成SO32mol
C.放出197kJ热量D.含氧原子共8mol
【答案】A
【解析】
A.从方程式2SO2(g)+O2(g)![]() 2SO3(g)中可以看出,SO2与SO3的化学计量数相等,在化学反应过程中,SO2减少的物质的量与SO3增加的物质的量相等,故达平衡时,SO2和SO3共2mol,A正确;
2SO3(g)中可以看出,SO2与SO3的化学计量数相等,在化学反应过程中,SO2减少的物质的量与SO3增加的物质的量相等,故达平衡时,SO2和SO3共2mol,A正确;
B. 因为反应为可逆反应,所以2molSO2不可能全部转化为SO3,从而得出生成SO3<2mol,B错误;
C. 从热化学方程式可以看出,2molSO2全部反应,放出197kJ热量,但由于参加反应的SO2<2mol,所以放热<197kJ,C错误;
D. 2molSO2和1mol O2中,共含氧原子共6mol,所以反应后的混合物中,含氧原子也应为6mol,D错误。
故选A。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.放热反应一定能自发的进行
B.SO2能使品红溶液和溴水褪色,说明SO2具有漂白性
C.将AlCl3溶液和Al2(SO4) 3溶液分别蒸干灼烧,所得产物均为Al2O3
D.由反应AgCl(s) +KI(aq)![]() Ag I(s) + KCl (aq) 可知Ksp(AgCl)>Ksp(Ag I)
Ag I(s) + KCl (aq) 可知Ksp(AgCl)>Ksp(Ag I)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的pH与氢氧化钠溶液体积V的关系如图所示。下列说法不正确的是( )
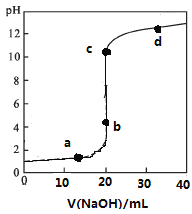
A.可选酚酞或甲基橙作指示剂
B.滴定前HR溶液中存在大量HR分子
C.V=20mL时,溶液中水电离的:c(H+)×c(OH-)=1×10-14mol2/L2
D.c点时溶液中离子浓度大小关系有c(Na+)>c(R-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1) 图1是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH________0(填“>”“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图2所示。则该反应的平衡常数为______________。
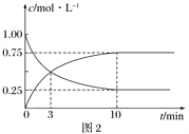
③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2) 在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;该温度下上述反应的化学平衡常数为________。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________________。
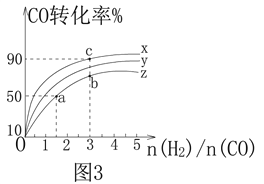
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知299 K时,合成氨反应 N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJB. 一定等于92.0 kJ
C. 一定小于92.0 kJD. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在室温下可能大量共存的是( )
A.pH=2的溶液:HCO3-、Na+、ClO-、NO3-
B.![]() =106的溶液:Al3+、NH4+、CO32-、S2-
=106的溶液:Al3+、NH4+、CO32-、S2-
C.水电离出的c(H+)=10-4mol/L的溶液:Na+、Fe3+、SO42-、Cl-
D.使石蕊呈红色的溶液:NH4+、NO3-、AlO2-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业利用氟磷灰石[Ca5(PO4)3F]生产磷铵[(NH4)3PO4]和白磷。其工艺流程如下图所示:
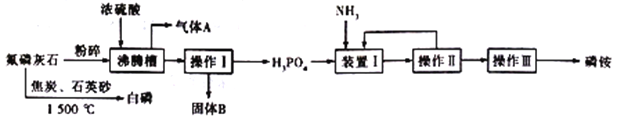
(1)氟磷灰石中磷元素的化合价为________,气体A 的电子式为________________;固体B 的化学式为____________________________。
(2)沸腾槽不能用陶瓷材质的原因是_______________________(用化学方程式表示)。
(3)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500 ℃生成白磷,同时逸出SiF4和CO,该反应的化学方程式为____________________________。
(4)在装置I中通入过量氨气的目的是___________________________________________。
(5)磷铵与草木灰不能混合使用的原因是______________________________________。
(6) (NH4)3PO4溶液中含磷离子浓度的大小顺序是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,AG=lg![]() 。下列叙述中正确的是( )
。下列叙述中正确的是( )
①任何温度下,纯水的AG等于0
②溶液的AG越小,酸性越强
③25 ℃时,0.1 mol·L-1盐酸的AG=12
④25 ℃时,某溶液的AG=-10,其pH=10
A.①③ B.②④
C.①② D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com