
| 1 |
| 2 |
| m |
| V |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 2 |
| 2 |
| M |
| NA |
ρ(2
| ||
| 4 |
| M | ||
4
|
| M | ||
4
|


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
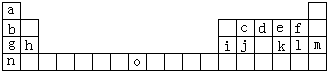
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
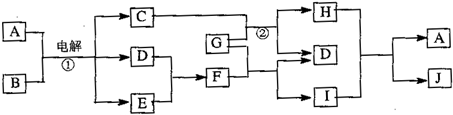
查看答案和解析>>
科目:高中化学 来源: 题型:
 将0.050mol SO2和0.030mol O2放入容积为1L的密闭容器中,在一定条件下发生如下反应:2SO2(g)+O2(g)?2SO3(g),△H=-196.64kJ/mol.
将0.050mol SO2和0.030mol O2放入容积为1L的密闭容器中,在一定条件下发生如下反应:2SO2(g)+O2(g)?2SO3(g),△H=-196.64kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| B、pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) |
| C、pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| D、pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
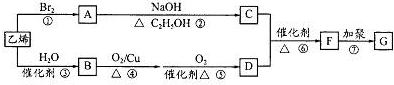
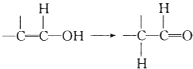 ,则E的结构简式为
,则E的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| n |
| 2 |
| 3n |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/°C | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
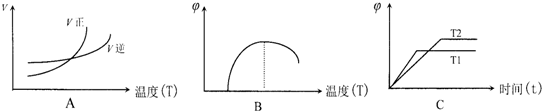
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com