解:有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复),
①A、C溶液pH均大于7,说明一种是强碱,一种是弱酸强碱盐,弱酸强碱盐是醋酸钠;
②C溶液和D溶液相遇只生成白色沉淀,说明一种溶液含有钡离子,一种溶液含有硫酸根离子;
B溶液和C溶液相遇时只生成刺激性气味的气体,说明一种溶液含有铵根离子,一种溶液含有氢氧根离子,A溶液和D溶液混合时无明显现象,且相同浓度的A、B的溶液中水的电离程度相同,所以A是醋酸钠、B是氯化铵、C是氢氧化钡、D是硫酸钠.
(1)通过以上分析知,A是醋酸钠、B是氯化铵、C是氢氧化钡、D是硫酸钠,故答案为:CH
3COONa;NH
4Cl;Ba(OH)
2;Na
2SO
4;
(2)钡离子和硫酸根离子反应生成硫酸钡沉淀,离子方程式为:Ba
2++SO
42-=BaSO
4↓,故答案为:Ba
2++SO
42-=BaSO
4↓;
(3)根据溶液中电荷守恒得c(H
+)+c(NH
4+)=c(OH
-)+c(Cl
-),根据溶液中物料守恒得 c(NH
3.H
2O)+c(NH
4+)=c(Cl
-),
将两个等式相减得c(H
+)-c(NH
3?H
2O)=c(OH
-)=10
a-14,故答案为:10
a-14;
(4)根据题意知,氯化铵和氢氧化钡的物质的量相等,混合后,溶液中的溶质是氨水、氯化钡和氢氧化钡,氯化钡和氢氧化钡的浓度相等,氨水的浓度是氯化钡和氢氧化钡浓度的2倍,溶液中氢氧根离子浓度最大,钡离子和氯离子浓度相等,氨水是弱碱部分电离导致氯离子浓度大于铵根离子浓度,溶液呈碱性,氢离子浓度最小,所以溶液中离子浓度大小顺序是c(OH
-)>c(Ba
2+)=c(Cl
-)>c(NH
4+)>c(H
+),
故答案为:c(OH
-)>c(Ba
2+)=c(Cl
-)>c(NH
4+)>c(H
+);
(5)混合溶液的pH=11,则溶液中氢氧根离子浓度=
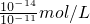
=10
-3 mol/L,设氢氧化钡的体积为X,盐酸的体积为Y,c(OH
-)=
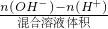
=

=10
-3 mol/L,X:Y=1:4,故答案为:1:4.
分析:有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复),
①A、C溶液pH均大于7,说明一种是强碱,一种是弱酸强碱盐,弱酸强碱盐是醋酸钠;
②C溶液和D溶液相遇只生成白色沉淀,说明一种溶液含有钡离子,一种溶液含有硫酸根离子;
B溶液和C溶液相遇时只生成刺激性气味的气体,说明一种溶液含有铵根离子,一种溶液含有氢氧根离子,A溶液和D溶液混合时无明显现象,且相同浓度的A、B的溶液中水的电离程度相同,所以A是醋酸钠、B是氯化铵、C是氢氧化钡、D是硫酸钠.
(2)钡离子和硫酸根离子反应生成硫酸钡沉淀;
(3)根据溶液中电荷守恒、物料守恒计算c(H
+)-c(NH
3?H
2O);
(4)根据题意知,氯化铵和氢氧化钡的物质的量相等,混合后,溶液中的溶质是氨水、氯化钡和氢氧化钡,氯化钡和氢氧化钡的浓度相等,氨水的浓度是氯化钡和氢氧化钡浓度的2倍,根据溶液中的溶质性质确定离子浓度关系;
(5)混合溶液的pH=11,则溶液中氢氧根离子浓度=
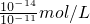
=10
-3 mol/L,根据C(OH
-)=
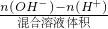
计算氢氧化钡和盐酸的体积之比.
点评:本题以化合物的推断为载体考查了物质的量的有关计算、离子浓度大小的比较等知识点,明确物质的性质是推断化合物的关键,本题的难点是判断溶液中离子浓度大小的比较,根据物料守恒和电荷守恒来判断即可,难点较大.

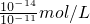 =10-3 mol/L,设氢氧化钡的体积为X,盐酸的体积为Y,c(OH-)=
=10-3 mol/L,设氢氧化钡的体积为X,盐酸的体积为Y,c(OH-)=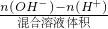 =
= =10-3 mol/L,X:Y=1:4,故答案为:1:4.
=10-3 mol/L,X:Y=1:4,故答案为:1:4.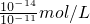 =10-3 mol/L,根据C(OH-)=
=10-3 mol/L,根据C(OH-)=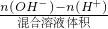 计算氢氧化钡和盐酸的体积之比.
计算氢氧化钡和盐酸的体积之比.

 阅读快车系列答案
阅读快车系列答案








