
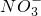 )=2mol/L.
)=2mol/L.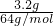 =0.05mol,与硝酸反应生成Cu2+,加水稀释至100mL,溶液中c(Cu2+)=
=0.05mol,与硝酸反应生成Cu2+,加水稀释至100mL,溶液中c(Cu2+)= =0.5mol/L,
=0.5mol/L,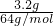 =0.05mol,与硝酸反应生成Cu2+,加水稀释至100mL,溶液中c(Cu2+)=
=0.05mol,与硝酸反应生成Cu2+,加水稀释至100mL,溶液中c(Cu2+)= =0.5mol/L,结合电荷守恒可计算稀释后溶液的c(H+);结合电子守恒和N元素守恒计算生成的气体中NO2和NO的物质的量.
=0.5mol/L,结合电荷守恒可计算稀释后溶液的c(H+);结合电子守恒和N元素守恒计算生成的气体中NO2和NO的物质的量.

科目:高中化学 来源:江苏省前黄高级中学2007届高三年级第一学期期中考试、化学试卷 题型:038
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2010年河北省唐山市高三上学期摸底考试化学试题 题型:选择题
将51.2gCu完全溶于适量浓硝酸中,在标况下收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共17.92 L,这些气体恰好能被400 mL 2.5 mol/LNaOH溶液完全吸收,溶液中生成NaNO3和。NaNO2,则原混合气体中NO的物质的量为 ( )
A.0.3 mol B.0.4 mol C.0.5 mol D.0.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO2、N2O4)的混合物共0.8 mol,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,溶液中生成NaNO3和NaNO2,则原混合气体中NO的物质的量为:
A.0.3 mol B.0.4 mol C.0.5 mol D.0.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将51.2gCu完全溶于适量浓硝酸中,在标况下收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共17.92 L,这些气体恰好能被400 mL 2.5 mol/LNaOH溶液完全吸收,溶液中生成NaNO3和。NaNO2,则原混合气体中NO的物质的量为 ( )
A.0.3 mol B.0.4 mol C.0.5 mol D.0.6 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com