
 氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.
氮化硼(BN)是新型无机非金属材料,可作润滑剂、高级耐火材料和超硬材料等,某兴趣小组以下装置用NH3与B2O3固体在高温下制备少量氮化硼.分析 (1)反应中需要制备氨气进行反应,实验前应进行的操作是检验装置气密性;
(2)NH3与B2O3固体在高温下制备少量氮化硼,根据原子守恒可知还生成水;
(3)装I中制备氨气,碱石灰干燥氨气,在Ⅲ中反应生成氮化硼,IV中浓硫酸吸收未反应的氨气,广口瓶可以防止倒吸;
(4)氨气能使湿润的蓝色石蕊试纸变红色;
(5)根据方程式利用差量法计算生成氮化硼的质量,根据B原子计算氮化硼的理论产量,进而计算氮化硼的产率;
(6)用NH3与BCl3在高温下反应制备氮化硼的同时会产生氯化氢,氯化氢对设备腐蚀.
解答 解:(1)反应中需要制备氨气进行反应,实验前应进行的操作是检验装置气密性,
故答案为:检验装置气密性;
(2)NH3与B2O3固体在高温下制备少量氮化硼,根据原子守恒可知还生成水,反应方程式为:B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O,
故答案为:B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O;
(3)装I中制备氨气,碱石灰干燥氨气,在Ⅲ中反应生成氮化硼,IV中浓硫酸吸收未反应的氨气,广口瓶可以防止倒吸,
故答案为:吸收未反应的氨气、防止倒吸;
(4)氨气能使湿润的蓝色石蕊试纸变蓝色,所以可以用湿润的蓝色石蕊试纸检验氨气是否剩余,
故答案为:用湿润的蓝色石蕊试纸检验;
(5)设实际产生BN的质量为xg,则:
B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O 固体质量减轻△m
50 20
x 8.4g-6.4g=2g
则50:20=xg:2g,所以x=5,
根据B元素守恒,8.4g B2O3固体理论上产生氮化硼的质量为$\frac{8.4g}{70g/mol}$×2×25g/molg=6g,所以氮化硼的产率为$\frac{5g}{6g}$×100%=83.3%,
故答案为:83.3%;
(6)用NH3与BCl3在高温下反应制备氮化硼的同时会产生氯化氢,氯化氢对设备腐蚀,导致成本升高,
故答案为:用NH3与BCl3在高温下反应会产生强酸性氯化氢,氯化氢对设备腐蚀,导致成本升高,故选择NH3与B2O3反应.
点评 本题考查物质制备,为高频考点,涉及物质检验、基本操作、基本计算,明确实验原理、基本操作规范性、各个物理量的关系是解本题关键,知道各个装置的作用及可能发生的反应,题目难点中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3是强电解质,BaCO3是弱电解质 | |
| B. | c(H+)=1×10-7mol•L-1的溶液一定呈中性 | |
| C. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| D. | 将0.1 mol•L-1醋酸溶液加水稀释时,电离能力增强,但c(H+)变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体中不存在独立的“分子” | |
| B. | 含有1 mol C的金刚石中,形成的共价键有2 mol | |
| C. | 是自然界中硬度最大的物质 | |
| D. | 化学性质稳定,即使在高温下也不会与氧气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10-3 | B. | 10-7 | C. | 10-11 | D. | 10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
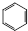 +HNO3$\stackrel{催化剂}{→}$
+HNO3$\stackrel{催化剂}{→}$ +H2O,反应类型取代反应
+H2O,反应类型取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将FeCl3溶液加热蒸干,可得到FeCl3固体 | |
| B. | 将PH=9的KOH溶液稀释1000倍后,其PH=6 | |
| C. | 用NaOH溶液滴定醋酸溶液时,不宜选用甲基橙作指示剂 | |
| D. | 碳酸溶液中氢离子浓度是碳酸根离子浓度的二倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓硝酸做试剂比较铁和铜的金属活动性 | |
| B. | 使用干燥洁净玻璃棒将氯水滴在干燥pH试纸上,测定氯水的pH | |
| C. | 欲检验Br-的存在,可在溶液中先加入氯水、再加入CCl4,振荡、静置,观察下层溶液显橙红色 | |
| D. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电荷 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列叙述正确的是
A.44g CO2含有氧原子数为NA
B.物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA
C.标准状况下,22.4L四氯化碳含有的分子数为NA
D.常温常压下,14g N2含有分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若T的最低化合价为-3,则J的最高正化合价为+6 | |
| B. | 若HnJOm为强酸,则G是位于ⅤA以后的活泼非金属元素 | |
| C. | 若M(OH)n+1为强碱,则R(OH)n也为强碱 | |
| D. | 若M的最高正化合价为+4,则五种元素都是非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com