
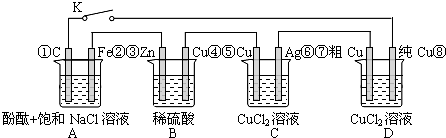
| A、当K闭合时,A装置发生吸氧腐蚀,在电路中做电源 |
| B、当K断开时,B装置锌片溶解,有氢气产生 |
| C、当K闭合后,整个电路中电子的流动方向为①→⑧;⑦→⑥;⑤→④;③→② |
| D、当K闭合后,A、B装置中pH变大,C、D装置中pH不变 |


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
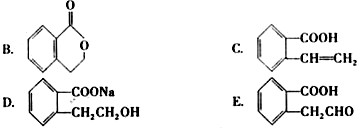
科目:高中化学 来源: 题型:
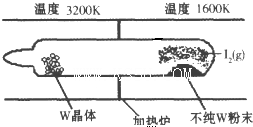 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.| 1 |
| 2 |
c(S
| ||
c(HS
|
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
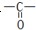 和C-OH两种原子团,A可能的结构简式为(写出一种即可)
和C-OH两种原子团,A可能的结构简式为(写出一种即可)查看答案和解析>>
科目:高中化学 来源: 题型:
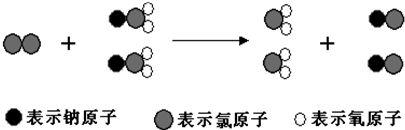
| A、该反应是复分解反应 |
| B、ClO2 的消毒效率(等质量时得到电子的多少)是Cl2 的2.63倍 |
| C、反应中Cl2既是氧化剂,又是还原剂 |
| D、生成2mol ClO2时转移的电子数为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使pH试纸显蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- |
| B、与铝粉反应放出氢气的无色溶液中:NO3-、Al3+、Na+、SO42- |
| C、使红色石蕊试纸变蓝的溶液中:SO42-、CO32-、Na+、K+ |
| D、pH=0的溶液中:Al3+、NH4+、Ca2+、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2O2Cl4 |
| B、KCl?MgCl2?6H2O |
| C、KMnO4 |
| D、Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和纯碱(Na2CO3)溶液中:c(Na+)=2c(CO32-) |
| B、pH=4的醋酸中:c(H+)=1.0×10-4mol?L-1 |
| C、0.10mol/L醋酸钠溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com