
 已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答:
已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答:分析 (1)升高温度,反应速率加快;
(2)恒温恒压下,继续充入2mol A和2mol B,与起始时A、B物质的量之比均为1:1,与原平衡为等效平衡,平衡时相同物质的含量相同;
(3)若反应在恒温恒容条件下进行并达到平衡,保持其他条件不变,向容器中通入稀有气体,各组分的浓度不变,反应速率不变,平衡不移动.
解答 解:(1)升高温度,C的反应速率加快,故答案为:加快;
(2)恒温恒压下,继续充入2mol A和2mol B,与起始时A、B物质的量之比均为1:1,与原平衡为等效平衡,平衡时相同物质的含量相同,故C的体积分数是40%,故答案为:40%;
(3)若反应在恒温恒容条件下进行并达到平衡,保持其他条件不变,向容器中通入稀有气体,各组分的浓度不变,反应速率不变,平衡不移动,图象变化为: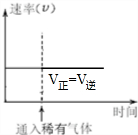 ,
,
故答案为: .
.
点评 本题考查化学平衡计算与影响因素、等效平衡、反应速率影响因素等,(2)中关键是对等效平衡规律的理解,难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示,2min后反应达到平衡.由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示,2min后反应达到平衡.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com