
| 时间/浓度 | c(NH3)(mol?L-1) | c(O2)(mol?L-1) | c(NO)(mol?L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
| A、反应在第2min到第4min时,O2的平均速率为0.1875mol?L-1?min-1 |
| B、反应在第2min时改变了某一条件,该条件可能是使用催化剂或升高温度 |
| C、第4min、第8min时分别达到化学平衡,且平衡常数相同 |
| D、在开始反应的前2min内,该反应放出0.05QKJ的热量 |
| 5 |
| 4 |
| △c |
| △t |
| Q |
| 4 |
| 5 |
| 4 |
| △c |
| △t |
| 1.35-0.975 |
| 2 |
| Q |
| 4 |


科目:高中化学 来源: 题型:
A、C(s)+
| ||
| B、2H2(g)+O2(g)═2H2O(g)△H═-571.6kJ/mol | ||
| C、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H═-802.3kJ/mol | ||
| D、C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(I)△H═-2800kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4KI+O2+2H2O═4KOH+2I2 | ||||
| B、2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2 | ||||
| C、I2+2NaClO3═2NaIO3+Cl2 | ||||
D、MnO2+4HCl
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+2a | ||
| B、+a | ||
C、+
| ||
D、+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KHCO3溶液中混有K2CO3 ( CO2 ) |
| B、Mg中混有Al ( NaOH溶液 ) |
| C、Fe2O3中混有Al2O3 ( NaOH溶液) |
| D、Fe中混有Fe2O3 ( 盐酸 ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+ |
| B、Mg2+ |
| C、Cl- |
| D、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、Cl-、SO42- |
| B、Na+、NH4+、SO42-、HCO3- |
| C、Na+、Ba2+、NO3-、Cl- |
| D、K+、Na+、NO3-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示:
在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示:| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
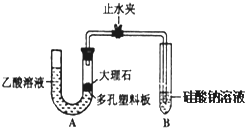 某校学习小组进行下述实验,探究CH3COOH、H2CO3和H2SiO3
某校学习小组进行下述实验,探究CH3COOH、H2CO3和H2SiO3查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com