
(13分)在固定容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g)随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g)随温度升高,混合气体的颜色变深。回答下列问题:
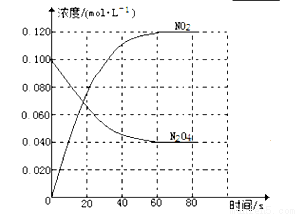
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 。 反应的平衡常数K1= 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②100℃时达到平衡后,向容器中再充入0.20mol NO2气体,新平衡建立后,NO2的体积分数
(填“增大”、“不变”或“减小”)
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源:2015-2016学年重庆巴蜀中学高一上10月月考化学试卷(解析版) 题型:选择题
2015年8月12日天津港危险品仓库发生的爆炸事故,再次警示人们在注重提高科技化工发展水平的同时,不可忽视化学试剂存放的基本问题。下列在实验室中关于试剂存放叙述正确的是

A.白磷不易挥发,不需要密闭存放;
B.氢氧化钠溶液应保存在带玻璃塞的细口试剂瓶中
C.氰化物的包装标签上应贴上如图所示的标志
D.用容量瓶配制好溶液进行贮存时,需在容量瓶上贴上浓度标签
查看答案和解析>>
科目:高中化学 来源:2015-2016学年北京大学附属中学分校高一上抽考化学试卷(解析版) 题型:选择题
下列反应中,氧化剂与还原剂的物质的量的关系为 1:2 的是
A.O3+2KI+H2O═2KOH+I2+O2
B.Ca(ClO)2+2CH3COOH═2HClO+Ca(CH3COO)2
C.I2+2NaClO3═2NaIO3+Cl2
D.4HCl(浓)+MnO2  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期9月学情调研化学试卷(解析版) 题型:选择题
下列各选项中,不能利用置换反应通过Y得到W的一组化合物是
选项 化合物 | A | B | C | D |
Y | CO2 | Fe2O3 | H2O | FeCl3 |
W | MgO | Al2O3 | HF | CuCl2 |
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三上学期第二次教学质检化学试卷(解析版) 题型:选择题
向30mL 1mol/L的AlCl3溶液中逐渐加入浓度为4mol/L的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为
A.3mL B.7.5mL C.15mL D.17.5mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二10月月考化学试卷(解析版) 题型:选择题
已知H2(g)+I2(g) 2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲、乙提高相同温度 B.甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D.甲增加0.1molH2 ,乙增加0.1mol I2
查看答案和解析>>
科目:高中化学 来源:2016届四川省雅安市高三9月月考化学试卷(解析版) 题型:实验题
(本题共18分)配制480 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)选择仪器:完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________等。
(2)计算、称量:需称量NaOH固体的质量为________。
(3)溶解、冷却,该步实验中需要使用玻璃棒,作用是___________________。
(4)转移、洗涤。洗涤烧杯2~3次是为了______________________________。
(5)定容、摇匀。定容的具体操作是___________________________________。
(6)不规范的实验操作会导致实验结果的误差,下列使所配溶液的物质的量浓度偏高的是 ,偏低的是 ,无影响的是 (填字母序号)。
A、容量瓶洗净后未烘干;
B、在溶解过程中有少量液体溅出烧杯外
C、定容时俯视刻度线;
D、将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容
E、定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期第一次月考化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关。下列说法正确的是
A.金属材料都是导体,非金属材料都是绝缘体
B.硅材料广泛用于光纤通讯
C.绿色食品是不含任何化学物质的食品
D.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
查看答案和解析>>
科目:高中化学 来源:2016届浙江省温州市高三上学期返校联考化学试卷(解析版) 题型:填空题
I.(7分)请回答:
(1)CO2的电子式 。
(2)钠燃烧不能用CO2灭火,用化学方程式表示其理由 。
(3)重晶石(BaSO4)不溶于酸,用饱和Na2CO3处理转化为易溶于酸的BaCO3,写出反应的离子方程式 。
(4)完成以下氧化还原反应的离子方程式:
( )Cr2O + ( )H2O2+ _____ =( ) Cr3++ ( ) O2 ↑ + ________
+ ( )H2O2+ _____ =( ) Cr3++ ( ) O2 ↑ + ________
II.(8分)化合物K3Fe(A2B4)3·3H2O是重要的催化剂。将化合物K3Fe(A2B4)3·3H2O受热完全分解,只得到气体产物和固体产物。经分析,气体产物只有甲、乙和水蒸气。已知甲、乙均由A、B两元素组成,且摩尔质量:M(甲)<M(乙)。A元素的最外层电子数是次外层电子数2倍,B元素的主族序数是其所在周期数的3倍。经分析,固体产物只有Fe、FeO 和K2AB3。某同学再进行以下定量分析。
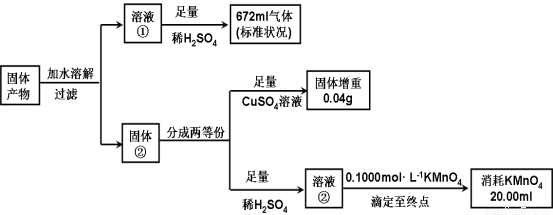
(1)甲的化学式: 。
(2)溶液②与KMnO4发生氧化还原的离子方程式: 。
(3)由以上实验数据的分析可知n(Fe):n(FeO) :n(K2AB3) = : : 。
(4)某同学认为:溶液②由紫红色变为无色,振荡试样半分钟内不变色,即可证明溶液②与KMnO4溶液反应到达滴定终点。判断该同学设想的合理性并说明理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com