
【题目】一种重要的有机化工原料有机物X,如图是以它为初始原料设计出的转化关系图(部分产物、合成路线、反应条件略去)。Y是一种功能高分子材料。
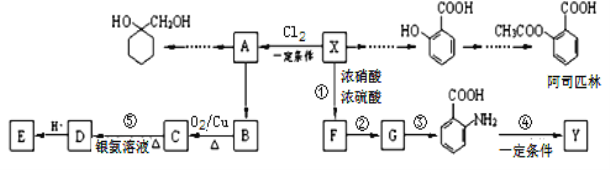
已知:(1)X为芳香烃,其相对分子质量为92
(2)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:![]()
(3)![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为___________;
(2)![]() 中含氧官能团的名称为___________________________;
中含氧官能团的名称为___________________________;
(3)反应①的反应类型是_______________;
已知A为一氯代物,则E的结构简式是____________________________________;
(4)反应④的化学方程式为___________________________________________________________;
(5)请写出以A为原料制备![]() 的合成路线流程图(无机试剂任用)。_________________。
的合成路线流程图(无机试剂任用)。_________________。
【答案】 C7H8 酚羟基、羧基 取代反应 ![]() n
n![]() →
→  +(n-1)H2O
+(n-1)H2O 
【解析】相对分子质量为92的某芳香烃X是一种重要的有机化工原料,令分子组成为CxHy,则![]() =7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃甲的分子式为C7H8,结构简式为
=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃甲的分子式为C7H8,结构简式为![]() ,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为
,X与氯气发生取代反应生成A,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,故A为![]() ,B为
,B为![]() ,C为
,C为![]() ,D酸化生成E,故D为
,D酸化生成E,故D为![]() ,E为
,E为![]() ,
,![]() 在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为
在浓硫酸、加热条件下与浓硝酸发生取代反应生成F,结合反应③的产物可知F为![]() ,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为
,F转化生成G,由于苯胺容易被氧化,由反应信息Ⅰ、反应信息Ⅱ可知,G为![]() ,
,![]() 发生反应生成Y,Y为功能高分子化合物,故Y的结构简式为
发生反应生成Y,Y为功能高分子化合物,故Y的结构简式为 。(1)通过以上分析知,X分子式为C7H8;(2)
。(1)通过以上分析知,X分子式为C7H8;(2)![]() 中含氧官能团的名称为酚羟基和羧基;(3)反应①是
中含氧官能团的名称为酚羟基和羧基;(3)反应①是![]() 在浓硫酸的催化下与浓硝酸发生硝化反应生成
在浓硫酸的催化下与浓硝酸发生硝化反应生成![]() ,共反应类型是硝化反应,也属于取代反应;已知A为一氯代物,则E的结构简式是
,共反应类型是硝化反应,也属于取代反应;已知A为一氯代物,则E的结构简式是![]() ;(4)邻氨基苯甲酸在一定条件下反应生成Y,反应④的化学方程式为:n
;(4)邻氨基苯甲酸在一定条件下反应生成Y,反应④的化学方程式为:n![]() →
→  +(n-1)H2O;(5)
+(n-1)H2O;(5)![]() 在催化剂条件下发生加成反应生成
在催化剂条件下发生加成反应生成![]() ,再在氢氧化钠醇溶液、加热条件下发生消去反应生成
,再在氢氧化钠醇溶液、加热条件下发生消去反应生成![]() ,与氯气发生加成反应生成
,与氯气发生加成反应生成![]() ,最后在氢氧化钠水溶液中发生水解反应生成
,最后在氢氧化钠水溶液中发生水解反应生成![]() ,合成反应流程图为:
,合成反应流程图为: 。
。


科目:高中化学 来源: 题型:
【题目】两种气态烃以一定比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )
A.CH4 C2H4
B.CH4 C3H6
C.C2H4 C3H4
D.C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室用50 mL 0.50mol/L盐酸、50mL 0.55 mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
完成下列问题:
(1)图中实验装置中尚缺少的玻璃仪器是____________________________.
(2)在操作正确的前提下,提高中和热测定准确性的关键是________________________.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=_________[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算].
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_____(填“偏大”、“偏小”、“不变”).如改用60 mL0.5moI/L的盐酸与50 mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等”或“不相等”),所求中和热_____(填“相等”或“不相等”)。
(5) 上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)______.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B. 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取NaOH溶液时仰视计数
E.大烧杯的盖扳中间小孔太大。
Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:

(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥_______。
(2)试验编号②和③探究的内容是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=__________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X 为阳离子交换膜。下列有关说法正确的是

A. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B. 乙装置中铁电极为阴极,电极反应式为Fe-2e-= Fe2+
C. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
D. 通入氧气的一极为正极,发生的电极反应为O2 - 4e- + 2H2O = 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用离子方程式H++OH-=H2O表示的化学反应是( )
A.氨水和稀盐酸反应B.Ba(OH)2溶液和稀硫酸反应
C.KOH溶液和稀盐酸反应D.KOH溶液和CO2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(X代表卤素原子,R代表烃基) 
利用上述信息,按以下步骤从 ![]() 合成
合成 ![]() .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去)
请回答下列问题:
(1)分别写出B、D的结构简式:B_、D .
(2)反应①~⑦中属于消去反应的是 . (填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为: .
(4)试写出C→D反应的化学方程式(有机物写结构简式,并注明反应条件): .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CH3COOH溶液中存在如下平衡:CH3COOHCH3COO﹣+H+ . 加入少量下列物质或采取下述方法,能使平衡逆向移动的是( )
A.加水
B.CH3COONa固体
C.升温
D.NaCl固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com