
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
某氮肥厂氨氮废水中的氮元素多以NH4+和![]() 的形式存在,该废水的处理流程如下:
的形式存在,该废水的处理流程如下:

过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用: 。
②用化学平衡原理解释通空气的目的: 。
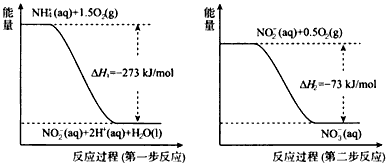
过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成![]() 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:


①第一步反应是 反应(选题“放热”或“吸热”),判断依据是 。
②1mol NH4+(aq)全部氧化成![]() 的热化学方程式是 。
的热化学方程式是 。
(3) 过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗![]() 转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某氮肥厂氨氮废水中的氮元素多以NH4+和![]() 的形式存在,该废水的处理流程如下:
的形式存在,该废水的处理流程如下:![]()
(1) 过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用: 。
②用化学平衡原理解释通空气的目的: 。
(2) 过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成![]() 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:


①第一步反应是 反应(选题“放热”或“吸热”),判断依据是 。
②1mol NH4+(aq)全部氧化成 的热化学方程式是 。
的热化学方程式是 。
(3) 过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗![]() 转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com